Chiara Guglielmi, Rossella Del Toro, Chiara Di Emidio
Dipartimento di Endocrinologia e Diabetologia, Università Campus Bio Medico di Roma
Diabete di tipo 1
Il diabete di tipo 1 (T1D) si sviluppa come risultato di una cronica e progressiva distruzione delle beta-cellule pancreatiche. Questo danno dipende da una perdita selettiva di tolleranza immunitaria che porta ad una un’estesa infiltrazione delle isole pancreatiche da parte di linfociti T citotossici. Il meccanismo autoimmune è confermato dalla presenza in circolo di un pool di auto-anticorpi (Abs) ancor prima dell’insorgenza della malattia: anti decarbossilasi dell’acido glutammico (GAD), anti-tirosina fosfatasi (IA 2) e anti-insulina (IAA). Questo processo, una volta avviato porta all’insorgenza della malattia sul piano clinico (1). Oltre al meccanismo autoimmune esistono altri componenti patogenetici che partecipano allo sviluppo della malattia e dunque il T1D può essere considerato una tipica malattia multifattoriale autoimmune. Caratteristiche genetiche, aspetti immunologici e fattori ambientali hanno un peso diverso nel determinare l’insorgenza del T1D a seconda dell’età alla diagnosi. La suscettibilità genetica ricopre un peso importante nell’insorgenza del T1D; maggiore è il rischio e più precoce sarà la comparsa della malattia. Negli ultimi anni l’incidenza del T1D è aumentata progressivamente, in particolare nella popolazione pediatrica.
L’esordio clinico della patologia rappresenta la fase terminale di un progressivo esaurimento delle cellule beta pancreatiche funzionanti che spesso è preceduto da un periodo asintomatico che può durare addirittura per diversi anni (2-3). Al momento della diagnosi di T1D, il paziente presenta spesso una grave riduzione della massa beta-cellulare e solo il 15-20% delle beta-cellule è ancora in grado di produrre insulina (4).
Diversi sono i fattori che partecipano al processo che determina la disfunzione beta-cellulare e tale meccanismo una volta instauratosi conduce alle seguenti alterazioni: a) riduzione della massa beta-cellulare, b) alterata produzione di insulina, c) alterazioni nel processo di attivazione della proinsulina in insulina.
Preservare questo esiguo numero di cellule deve essere dunque l’obiettivo cruciale di ogni diabetologo che si trovi di fronte ad un paziente con una neodiagnosi di T1D.
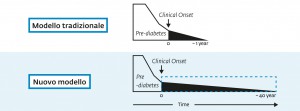
Fino a qualche anno fa si riteneva che entro un anno dalla diagnosi di T1D la massa beta-cellulare fosse completamente esaurita. Le metodiche di laboratorio oggi disponibili, sempre più precise e sensibili, hanno invece dimostrato che il C-peptide è ancora dosabile anche in pazienti affetti da T1D di lunga durata (5) (Fig. 1).
A conferma di questo dato e sicuramente di grande interesse sono i dati riguardanti il C-peptide raccolti dal Diabetes Joslin Medalist Study (6). Questo studio ha dimostrato che più del 60% dei pazienti affetti da T1D da più di cinquant’anni mostrava livelli di C-peptide >0.03 nM.
I fattori che favorivano una migliore conservazione del C-peptide erano: miglior controllo glicemico, età maggiore alla diagnosi di T1D e genotipo HLA DR3 (6).
FAD ECM “IL DIABETE”
Questa rassegna fa parte di un percorso di formazione a distanza accreditato a livello nazionale e disponibile gratuitamente nell’aula virtuale della SID (http://www.fad.siditalia.it).
Per partecipare al corso occorre:
1. Leggere la rassegna (disponibile anche on-line)
2. registrarsi all’aula e iscriversi al corso “il Diabete”
3. rispondere on-line al quiz di verifica e compilare il questionario di valutazione dell’evento FAD.
Una volta eseguito con successo il test di valutazione e compilato il questionario di valutazione dell’evento, sarà cura della Segreteria ECM della SID far pervenire l’attestato ECM del corso ai diretti inte- ressati nei tempi e nelle modalità stabiliti dalla regolamentazione vigente.
Per ulteriori informazioni: http://www.fad.siditalia.it