Emanuela Orsi
Servizio di Diabete e Malattie Metaboliche, Fondazione Cà Granda IRCCS Ospedale Maggiore Policlinico di Milano
Introduzione
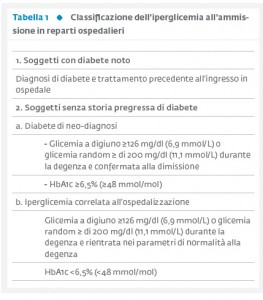
L’incremento della glicemia è una condizione che i pazienti spesso presentano all’ingresso in ospedale e durante la degenza, in concomitanza con eventi acuti, quali patologie di tipo internistico, traumatismi, ustioni ed interventi chirurgici. In particolare, la prevalenza di pazienti con glicemia >140 mg/dl all’ingresso in ospedale è del 32-40% e questo dato comprende sia i diabetici già noti che i soggetti senza storia pregressa di malattia. Questi ultimi, a loro volta, includono pazienti con diabete misconosciuto o di nuova insorgenza e soggetti con iperglicemia da stress, ovvero una condizione transitoria che compare durante una patologia acuta e scompare con la risoluzione della stessa, senza successiva evidenza di diabete mellito. Per individuare questa categoria di pazienti, può essere d’aiuto il dosaggio dell’emoglobina glicata (HbA1c) (1-3) (Tab. 1).
Nel complesso, i soggetti senza storia pregressa di malattia rappresentano circa un terzo dei pazienti con iperglicemia ricoverati in reparti non critici e più dell’80% di quelli ricoverati in aree critiche (4-6).
L’iperglicemia all’ingresso in ospedale, sia nei diabetici noti che in soggetti senza precedente diagnosi di diabete, compresi quelli con iperglicemia da stress, comporta un incremento del rischio di morbilità e mortalità e un allungamento della degenza, con aumento dei costi economici per l’ospedalizzazione (7-10). Il trattamento dell’iperglicemia, che dovrà essere istituito anche in caso di iperglicemia transitoria, è più frequentemente rappresentato dalla terapia insulinica e gli obiettivi glicemici dovranno essere modulati in base alle condizioni del paziente e al tipo di patologia acuta intercorrente. In considerazione dello sviluppo di farmaci innovativi per la cura del diabete e del loro meccanismo d’azione, è possibile ipotizzare un utilizzo futuro anche delle nuove molecole nel trattamento dell’iperglicemia acuta in regime ospedaliero (6).
> Scarica l’articolo in formato PDF
Fisiopatologia dell’iperglicemia acuta in ospedale
Come detto, l’iperglicemia acuta in ospedale può sottendere diverse condizioni, permanenti o transitorie. Sebbene quest’ultima condizione venga definita iperglicemia da stress, lo stress legato all’evento acuto che ha portato all’ospedalizzazione rappresenta un meccanismo comune a tutte le forme di iperglicemia acuta in ospedale, in quanto peggiora il controllo glicemico in un paziente con diabete noto e smaschera la presenza di un diabete misconosciuto o di nuova insorgenza (9).
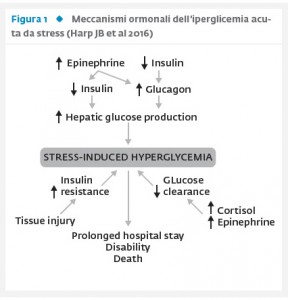
L’iperglicemia durante gli eventi acuti è la risultante di complesse interazioni fra gli elevati livelli di ormoni contro-insulari (glucagone, epinefrina e cortisolo), che sostengono l’incremento glicemico e l’insulino-resistenza, e il deficit relativo di insulina, che impedisce un efficace compenso agli effetti iperglicemizzanti di questi ormoni (Fig. 1).
Vi sono studi che hanno altresì dimostrato come, nelle fasi precoci di eventi acuti, quali accidenti cardiovascolari, traumi e ustioni, vi sia un deficit di secrezione insulinica che determina l’iperglicemia, mentre nelle successive fasi di stabilizzazione della patologia sia prevalente l’insulino-resistenza, soprattutto in relazione alla severità del danno tissutale (6).
La patogenesi dell’iperglicemia nel periodo peri-operatorio è schematizzata in figura 2.
Oltre ai meccanismi della contro-regolazione e all’eccesso di citochine pro-infiammatorie circolanti che caratterizzano lo stress fisiologico, anche l’insulino-resistenza transitoria e l’alterazione del segnale insulinico contribuiscono a sostenere l’iperglicemia nel periodo peri-operatorio, sia nei diabetici noti che nei soggetti senza storia pregressa. Inoltre, le procedure chirurgiche (in regione addominale e toracica in particolare) ed anestesiologiche giocano un ruolo importante sia nel generare l’incremento della glicemia di per sé che nel prolungare la durata dell’iperglicemia stessa (11). Da qui l’interesse per l’utilizzo di tecniche chirurgiche meno invasive (es. laparoscopia) e procedure anestesiologiche particolari (es. scelta di fluidi per la sedazione che possano modulare l’attività simpatica) per ridurre l’iperglicemia post-operatoria.
Nella rassegna di Harp et al (6), gli Autori hanno puntualizzato il ruolo del glucagone nel determinare l’iperglicemia da stress durante eventi acuti, stigmatizzando il difetto dei meccanismi di soppressione della secrezione del glucagone stesso da parte dei fattori inibitori. In particolare, l’effetto inibitorio dall’insulina, esercitato con meccanismi paracrini a livello delle isole pancreatiche, risulta insufficiente e non verrebbe ripristinato neppure da dosi soprafisiologiche di insulina stessa (12). A questo meccanismo si aggiunge l’azione dell’epinefrina, che stimola direttamente la produzione di glucagone. Infatti, in condizioni fisiologiche, l’effetto dell’epinefrina sul glucagone risulta essere modesto, per aumentare di circa 1000 volte rispetto al valore di base durante le patologie acute (13). Infine, anche il cortisolo agisce sul glucagone con modalità simili a quelle dell’epinefrina, sia in condizioni fisiologiche che in condizioni critiche, contribuendo al peggioramento l’iperglicemia. Oltre ai meccanismi fisiopatologici descritti che operano durante le malattie intercorrenti, va ricordato che l’iperglicemia può essere determinata o peggiorata dall’utilizzo di farmaci iperglicemizzanti quali ad esempio corticosteroidi, octreotide o immunosoppressori.
Trattamento dell’iperglicemia acuta in ospedale
Studi iniziali sul trattamento dell’iperglicemia in pazienti critici hanno dimostrato un migliore outcome e una riduzione della durata della degenza nelle Unità di Terapia Intensiva post-chirurgica (14). Risultati simili sono stati osservati in soggetti trattati in modo intensivo durante infarto del miocardio (10, 15), ictus (16) e scompenso cardiaco (17), rispetto a soggetti in cui gli obiettivi terapeutici erano meno stringenti e di conseguenza il trattamento meno intensivo. Inoltre, in questi studi, i soggetti che presentavano iperglicemia acuta senza storia pregressa di diabete mellito mostravano outcome peggiori rispetto ai diabetici noti (16, 18). Questi risultati hanno favorito lo sviluppo di algoritmi terapeutici intensivi per la gestione dell’iperglicemia acuta in ambiente ospedaliero (14, 19).
Studi successivi non hanno però confermato un beneficio sulla mortalità se si perseguivano obiettivi più stringenti. Lo studio multicentrico randomizzato e controllato, in aperto, denominato NICE-SUGAR, ha valutato in più di 6000 pazienti l’effetto del controllo glicemico stringente rispetto alla morbilità per tutte le cause entro 90 giorni e alla mortalità. I soggetti con un target glicemico più ambizioso (81-108 mg/dl) avevano un più alto rischio di morbilità a 90 giorni dalla dimissione e di mortalità rispetto a pazienti che avevano come obiettivo una glicemia <180 mg/dl (20). Inoltre, gli Autori hanno sottolineato come gli episodi ipoglicemici fossero più frequenti nel gruppo con obiettivi più ambiziosi, anche se non è possibile affermare che fossero la causa diretta degli eventi avversi verificatisi successivamente. Una ulteriore analisi del NICE-SUGAR (21) e altri studi (22-23) hanno altresì evidenziato come gli episodi ipoglicemici associati al trattamento intensivo fossero indipendentemente correlati all’eccesso di mortalità, a indicare la necessità di modulare gli obiettivi terapeutici in base alla condizione del paziente (24). Questo orientamento è stato recepito dalle più recenti linee guida sul trattamento dell’iperglicemia in ospedale (1-2).
Infine, un ruolo importante nel determinare un incremento del rischio di morte in soggetti in condizioni critiche è stato attribuito anche alla variabilità glicemica. Infatti, la fluttuazione della glicemia, con il susseguirsi di episodi iperglicemici ed ipoglicemici, è correlata in modo indipendente con l’incremento della mortalità in soggetti ospedalizzati in reparti di Terapia Intensiva (25-27).
Obiettivi glicemici e monitoraggio glicemico
Nella popolazione generale, esiste una stretta relazione tra livelli di glicemia e mortalità intra-ospedaliera, come dimostrato da uno studio che ha raccolto i dati di circa 260.000 pazienti ricoverati Unità di terapia Intensiva medica, chirurgica e cardiologica (28). Inoltre, due studi multicentrici hanno dimostrato come i migliori outcome si osservassero nei soggetti il range di glicemia inferiore. Lo studio SCOAP-CERTAIN ha valutato retrospettivamente un database della Veterans Administration in cui erano inclusi 40.000 pazienti con riscontro di iperglicemia durante il ricovero, dimostrando una relazione dose-risposta tra glicemia ed eventi avversi nei soggetti non diabetici, ma non in quelli diabetici (29). Lo studio GLUCO-CABG, randomizzato e controllato, ha esaminato soggetti sottoposti a by-pass coronarico valutando gli esiti dell’intervento, che erano migliori nei pazienti senza storia di diabete con range glicemico compreso tra 110 e 140 mg/dl rispetto a quelli con valori compresi fra 140 e 180 mg/dl, mentre nessuna differenza era presente nei diabetici (30).
Queste osservazioni unitamente a quelle precedentemente menzionate riguardo all’impatto negativo dell’ipoglicemia sulla mortalità dei soggetti con iperglicemia trattati in maniera intensiva, hanno portato ad una rivisitazione dei target glicemici. Infatti, pur confermando l’importanza di mantenere un buon controllo della glicemia nel corso del ricovero, gli obiettivi glicemici sono stati resi meno stringenti e da personalizzare in base alla condizione del paziente, bilanciando così la necessità di trattare l’iperglicemia con la prevenzione dell’ipoglicemia. I target attualmente considerati nei soggetti ospedalizzati sono presentati in tabella 2 e sono differenti per i pazienti critici, che sono ricoverati in reparti di terapia intensiva e necessitano di elevata intensità di cure, e i pazienti non critici, ricoverati in reparti internistici o di chirurgia generale, che necessitano di media o bassa intensità di cura (31,1-2). I target glicemici sono invece gli stessi sia per pazienti con diabete noto che in quelli con iperglicemia senza storia pregressa diabete.
Il monitoraggio glicemico è fondamentale nei pazienti critici, sottoposti a terapia insulinica infusionale, per la rivalutazione del dosaggio al fine di raggiungere il target glicemico evitando le ipoglicemie. Va ricordato inoltre che episodi ipoglicemici possono essere presenti anche in soggetti non in terapia ipoglicemizzante per l’alterata gluconeogenesi dovuta a patologie sottostanti di estrema gravità (32). In particolare, uno studio ha dimostrato che in pazienti critici in terapia insulinica, la misurazione della glicemia ogni ora porta il paziente ad avere per più tempo valori glicemici ottimali, con minori puntate iper- ed ipoglicemiche, e di conseguenza una minore variabilità glicemica, rispetto ad intervalli di tempo più lunghi tra le determinazioni (33). Le linee guida dell’American Diabetes Association e gli Standard di Cura Italiani suggeriscono per i pazienti critici in terapia insulinica in infusione venosa l’adozione di algoritmi semplici, sicuri e condivisi, in cui il monitoraggio glicemico avviene almeno ogni 1-2 ore.
Nei pazienti non critici, la frequenza dei controlli potrà essere differente, a seconda della terapia e del fatto che il paziente si alimenti o meno. In particolare, è auspicabile una misurazione almeno ogni 4-6 ore per pazienti che non si alimentano per os, mentre andranno effettuati controlli pre-prandiali e bed-time nei pazienti che si alimentano, con eventuale aggiunta di valutazioni post-prandiali se utili per la modifica terapeutica. È importante sottolineare che non è utile effettuare controlli random allo scopo di impostare la terapia insulinica secondo il modello “sliding scale”, cioè al bisogno, poiché si rischia di aumentare la variabilità glicemica. Il monitoraggio glicemico deve essere strutturato per impostare uno schema terapeutico, le eventuali modifiche del dosaggio e l’introduzione di eventuali boli correttivi.
In conclusione, l’obiettivo glicemico deve guidare alla stabilizzazione più che alla normalizzazione della glicemia ed il punto chiave è rappresentato dalla sicurezza del paziente ricoverato in ambito ospedaliero, evitando sia il rischio di ipoglicemia che di iperglicemia.
Approccio terapeutico nel paziente ospedalizzato critico e non critico
Non esistono specifiche linee guida per il trattamento dell’iperglicemia da stress o transitoria. In considerazione dei numerosi studi pubblicati e sopra riportati, relativi al rischio di morbilità e mortalità, l’approccio terapeutico deve essere lo stesso utilizzato per il trattamento dell’iperglicemia acuta in corso di diabete. Per ottenere ciò, vanno innanzitutto sensibilizzati gli operatori dei reparti non diabetologici a non sottostimare questa condizione e a mettere in atto le dovute strategie terapeutiche per ottenere il compenso glicemico durante l’ospedalizzazione.
La terapia di elezione per il trattamento dell’iperglicemia acuta in ospedale è rappresentata dall’insulina, nelle diverse vie di somministrazione, a seconda che il paziente sia critico o non critico. Gli ipoglicemizzanti orali nel diabete tipo 2 vengono di regola sostituiti dalla terapia insulinica, ad eccezione che nei pazienti in buon compenso glicometabolico nel periodo precedente al ricovero, con valori di glicemia stabili e in condizioni non critiche (1-2).
Nei pazienti critici, con elevata intensità di cura, ricoverati in Terapia Intensiva medica o chirurgica, si preferisce effettuare la terapia insulinica per via infusionale, con il dosaggio regolato da algoritmi specifici (34-37). La terapia insulinica per via endovenosa può essere indicata anche in caso di terapia steroidea ad alti dosaggi o durante il parto. Tali algoritmi devono essere condivisi dal team di cura, affinché possano essere utilizzati in sicurezza, e soprattutto devono essere di semplice applicazione, in modo da facilitare la comunicazione fra medico ed infermiere e non mettere a rischio il paziente (38). Va ricordato ancora come gli algoritmi devono tener conto della possibile ipoglicemia, che è un fattore determinante per l’aumento della mortalità e morbilità intra-ospedaliera e nel follow-up. A questo proposito, ad esempio, lo studio DIGAMI (39) è stato disegnato per verificare se l’infusione endovenosa acuta di insulina seguita dall’impostazione di uno schema insulinico sottocute verso la terapia convenzionale producesse un impatto positivo sul rischio di mortalità in soggetti ricoverati per infarto del miocardio con iperglicemia acuta. I risultati hanno confermato l’ipotesi di lavoro, ma non hanno definito se il beneficio fosse dovuto all’infusione acuta di insulina, al migliore controllo glico-metabolico intra-ospedaliero o nel follow-up successivo, o ad altri fattori, quali la concomitante somministrazione di glucosio e potassio. Al fine di chiarire questo aspetto, è stato pertanto disegnato lo studio DIGAMI 2 (40), che comprendeva i due gruppi di pazienti dello studio DIGAMI più un terzo, che veniva sottoposto a infusione acuta di insulina seguita dalla terapia convenzionale. I risultati non hanno confermato quelli dello studio precedente, anche per il mancato raggiungimento degli obiettivi glicemici pre-fissati e per problemi metodologici. Dalle analisi effettuate successivamente è emersa la necessità di un atteggiamento non aggressivo nel trattamento di pazienti ricoverati in area critica per infarto miocardico. In seguito, molti altri studi hanno stigmatizzato l’impatto negativo dell’ipoglicemia sugli esiti finali, da cui il suggerimento contenuto nelle linee guida di bilanciare obiettivi glicemici e rischio ipoglicemico nell’impostazione della terapia e nella scelta degli algoritmi di trattamento (1-2, 38). Vi sono molti esempi di algoritmi pubblicati in letteratura, alcuni validati ed altri costruiti autonomamente in diverse realtà ospedaliere, che differiscono tra loro per target glicemico e scala di correzione.
Tra i più noti algoritmi utilizzati vi è il protocollo di Yale, nella sua forma rivisitata nel 2012, che prevede la determinazione del dosaggio insulinico non solo in base ai valori assoluti di glicemia, ma anche all’andamento nel tempo della glicemia stessa (36, 2) (Fig. 3).
Questo algoritmo, disegnato per reparti di terapia intensiva per patologie internistiche e spesso modificato nelle diverse realtà ospedaliere, può anche essere gestito autonomamente dal personale infermieristico, se adeguatamente formato.
Un altro algoritmo interessante è quello sviluppato da Markovitz e colleghi per la gestione della terapia insulinica infusionale in pazienti sottoposti a interventi di cardiochirurgia (41). In questo caso, vengono proposti quattro differenti scale di correzione, a seconda del fabbisogno attuale del paziente in base alla sua sensibilità insulinica, al tipo di intervento chirurgico o alla presenza o meno di terapia steroidea (Fig. 4).
L’insulina utilizzata normalmente è quella regolare, a cinetica rapida. Nel caso si volesse utilizzare un analogo dell’insulina, va altresì segnalato che la glulisina non può essere impiegata in soluzione glucosata o Ringer (2, 42). I metodi più comuni per la somministrazione insulinica endovena sono l’associazione di insulina con soluzione fisiologica allo 0,9%, alla concentrazione di 1 UI/ml, l’associazione con glucosio e potassio (soluzione glucosata al 10%, 15 U/I di insulina rapida regolare e 10 mEq di cloruro di potassio), e le infusioni separate di insulina e glucosio mediante doppia pompa di infusione. La prima, essendo di più semplice gestione, è quella che viene più frequentemente utilizzata. L’impostazione, la velocità di infusione e le relative modifiche, come già indicato, vengono stabilite in base alle caratteristiche del paziente (sensibilità insulinica, tipo di intervento, terapie concomitanti, ecc.) e seguono algoritmi specifici, in base al valore glicemico rilevato (43).
Superata la fase critica, il paziente deve passare dalla terapia per via endovenosa a quella per via sottocutanea, secondo lo schema “basal-bolus”. Per far ciò, è necessario calcolare il fabbisogno insulinico basandosi sulle ultime 6-8 ore di somministrazione endovena e somministrare il 60-80% della dose sottocute. Il dosaggio può variare a seconda del tipo alimentazione (nutrizione naturale o artificiale) e della terapia concomitante o della sua sospensione (ad esempio i corticosteroidi). Se il paziente si alimenta attraverso la nutrizione enterale o parenterale in continuo, la dose calcolata va somministrata tutta come infusione basale, mentre se si alimenta per os, la dose totale va suddivisa in modo che il 50% venga somministrato come basale e il 50% come boli prandiali.
Nei pazienti non critici, che richiedono un livello medio o basso di intensità di cura, viene in genere preferita la terapia insulinica per via sottocutanea, secondo schemi programmati, che devono tenere conto del tipo di nutrizione (naturale o artificiale), delle terapie associate e delle condizioni generali del paziente. Gli schemi devono essere via via aggiornati in base si risultati del monitoraggio glicemico, aggiungendo eventualmente algoritmi di correzione, per evitare escursioni verso l’iper- o l’ipoglicemia e ridurre così la variabilità glicemica. Ovviamente, in caso di instabilità glico-metabolica, digiuno prolungato o periodo peri-operatorio, sarà necessario impostare la terapia insulinica endovenosa (34, 44, 4) secondo gli algoritmi precedentemente descritti.
Per impostare uno schema insulinico razionale è necessario stimare il fabbisogno insulinico giornaliero, ripartirlo correttamente nella giornata, scegliere il tipo di insulina e calcolare i boli di correzione. In particolare, il fabbisogno per pazienti che già praticano a domicilio la terapia insulinica potrebbe essere utilizzato per impostare il dosaggio in regime di ricovero, purché i valori di HbA1c indichino un buon compenso glicemico. La dose dovrebbe essere modulata in base alle terapie concomitanti (ad esempio i corticosteroidi), all’alimentazione, alla malattia acuta causa di ospedalizzazione, alla funzione renale o epatica, ecc.
Nei pazienti che non utilizzano insulina a domicilio, il fabbisogno può essere calcolato in base al peso corporeo e alle caratteristiche del paziente. In genere, la dose iniziale deve essere pari a 0.4 UI/Kg, da ridurre a 3 UI/Kg nei pazienti con rischio di ipoglicemia o incrementare a 0,5-0,6 fino a 1 UI/Kg nei soggetti con iperglicemie severe o con elevata insulino-resistenza (43). Dopo aver calcolato il fabbisogno insulinico giornaliero, va impostato lo schema “basal-bolus”, somministrando circa il 40-50% come infusione basale e il restante 50-60% come boli, di cui il 15-20% a colazione e il resto suddiviso tra il pranzo e la cena. Ovviamente il dosaggio deve essere modulato nel corso del ricovero, in base alle condizioni del paziente e ai controlli glicemici che debbono essere effettuati con regolarità, in modo da evitare ipoglicemie o il persistere dell’iperglicemia (4). Il tipo di insulina preferibilmente utilizzato in ospedale è rappresentato dagli analoghi, per il tipo di cinetica, la flessibilità d’uso e il minor rischio di ipoglicemia rispetto all’insulina rapida regolare e all’insulina NPH. Per i boli correttivi, che possono essere necessari per puntate iperglicemiche nel periodo inter-prandiale, si consigliano dosi variabili tra 1 e 4 U per ogni incremento di glicemia >50 mg/dl al di sopra di 150 mg/dl, a seconda del grado di sensibilità insulinica dei soggetti (2). Generalmente, nei pazienti con glicemia stabile, per individuare il bolo di correzione, si calcola il “fattore di sensibilità insulinica”, che indica di quanto si riduce la glicemia utilizzando 1 UI di insulina. In base a ciò, si calcolano le unità da somministrare suddividendo il fabbisogno giornaliero per un valore costante pari a 1500 (per l’insulina rapida regolare) o 1800 (per l’analogo rapido) (2). Bisogna però considerare che in regime ospedaliero l’andamento glicemico può essere instabile e si possono verificare eventi intercorrenti che modificano in modo significativo la sensibilità insulinica, per cui i valori calcolati sarebbero inapplicabili. In figura 5 è rappresentata schematicamente la modalità di gestione dell’iperglicemia acuta in pazienti non critici.
Un concetto importante da sottolineare, ripreso dalle linee guida, è che la modifica del dosaggio insulinico non va mai effettuata al bisogno (“sliding scale”), ma secondo gli schemi terapeutici specifici sopra riportati. Gli studi RABBIT 2 e RABBIT 2 surgery ad esempio, condotti su pazienti non critici ricoverati rispettivamente in reparti internistici e chirurgici, hanno dimostrato chiaramente come l’utilizzo di algoritmi per la gestione della terapia insulinica sottocutanea basal-bolus rispetto all’uso dell’insulina al bisogno si associassero ad un miglior compenso glicemico e ad un minor numero di complicanze in regime ospedaliero, anche se questo obiettivo è stato ottenuto solo nei soli pazienti sottoposti ad intervento chirurgico (45-46).
Trattamento dell’iperglicemia acuta in situazioni particolari
Paziente anziano fragile. Il trattamento dell’iperglicemia nell’anziano fragile rappresenta un problema rilevante in ospedale. In generale, in questa tipologia di pazienti, con importanti co-morbilità o con una aspettativa di vita breve si considerano obiettivi glicemici meno restrittivi che nel giovane adulto, mantenendo i livelli di HbA1c al di sotto di 8,0% (64 mmol/mol) (1-2, 47).
In particolare, è assolutamente necessario evitare l’ipoglicemia, che si associa in questi pazienti a un elevato rischio di morbilità e mortalità. Nei soggetti non critici e stabili, in cui è possibile utilizzare farmaci orali, vanno comunque evitati gli ipoglicemizzanti della classe dei secretagoghi, in quanto l’accumulo in circolo dovuto ad una funzione renale spesso non ottimale potrebbe generare una pericolosa ipoglicemia protratta, con conseguenze sull’apparato cardiovascolare, sul sistema nervoso e sull’apparato locomotore, con aumentato rischio di fratture causate da caduta a terra. Nelle situazioni più critiche, va impostata la terapia insulinica, sempre tendo conto della necessità di ottenere un obiettivo glicemico meno stringente. Inizialmente, il fabbisogno giornaliero può essere considerato pari a 0,3 UI di insulina per Kg di peso corporeo, da rivalutare in seguito in base ai valori di glicemia. Infine, data la possibile presenza di deficit cognitivi o di uno stato anoressico, è consigliabile somministrare analoghi rapidi alla fine del pasto, in modo da calibrare la dose in base agli alimenti effettivamente assunti (1-2).
Terapia con glucocorticoidi. Come è noto, l’aggiunta in terapia di questi farmaci può generare iperglicemia acuta, per cui è necessario istituire una terapia insulinica anche nei soggetti in trattamento con ipoglicemizzanti orali. In particolare, le linee guida consigliano una dose iniziale di 0,3-0,5 UI/Kg/die, da modulare in base alla risposta glicemica del paziente e alle modifiche del dosaggio dello steroide stesso. In tabella 3, viene riportato il calcolo della dose insulinica in base al peso e al tipo di steroide utilizzato. Alla sospensione del farmaco, è possibile ripristinare la terapia ipoglicemizzante domiciliare o passare alla dietoterapia, in base al grado compenso glicemico (1-2, 4).
Insufficienza renale. I soggetti con insufficienza renale e iperglicemia acuta in ospedale devono iniziare la terapia insulinica, il cui dosaggio va calcolato tenendo conto del filtrato glomerulare poiché in presenza di funzione renale ridotta diminuiscono sia la clearance dell’insulina che la gluconeogenesi renale, con aumentato rischio di ipoglicemia. In tabella 4 sono indicate le variazioni del dosaggio insulinico secondo in valore di filtrato glomerulare. In particolare, pazienti con insufficienza renale terminale possono avere un fabbisogno molto basso di insulina e il monitoraggio glicemico deve essere molto stretto per evitare l’ipoglicemia.
Per converso, l’iperglicemia è sostenuta, oltre che dalla malattia intercorrente, anche dalla resistenza insulinica che accompagna la nefropatia. Il fabbisogno insulinico giornaliero nel paziente con insufficienza renale deve quindi essere calcolato come pari a 0,3-0,4 UI/Kg, da modulare secondo i livelli glicemici. Se il filtrato è <45 ml/min è bene iniziare con una dose pari a 0,25-0,3 UI/Kg, di cui il 50% per come insulina basale e il 50% come boli prandiali. L’emodialisi migliora la resistenza insulinica, pertanto dopo la seduta è necessario ridurre di circa il 25% il dosaggio dell’insulina basale, senza modificare i boli prandiali. Differentemente, la dialisi peritoneale potrebbe causare un aumento del fabbisogno insulinico post-seduta poiché nel liquido dialitico è presente glucosio che viene lentamente assorbito dal peritoneo e causa un rialzo glicemico. In base al momento della giornata in cui viene effettuata, sarà opportuno modulare la successiva dose di insulina (48-50). Alla dimissione, se la situazione è stabile, si può ritornate alla terapia domiciliare, tenendo comunque conto delle indicazioni farmacologiche in base al grado di insufficienza renale. In tabella 5 sono riportate le indicazioni specifiche per ogni farmaco attualmente a disposizione, in base al valore del filtrato glomerulare (2).
Nutrizione enterale e parenterale. Il 40% dei pazienti critici presenta rischio di malnutrizione e conseguentemente di complicanze intra-ospedaliere ad essa associate, quali ad esempio le infezioni. Pertanto, per compensare il deficit nutritivo, i pazienti possono essere sottoposti a terapia nutrizionale artificiale. Ciò determina un peggioramento dell’iperglicemia, per cui è necessario impostare uno schema insulinico adeguato. In particolare, in corso di alimentazione enterale in continuo, viene suggerito di somministrare insulina glargine una volta al giorno, oppure detemir o NPH due volte al giorno. La quantità totale di insulina ad azione rapida deve essere distribuita durante la giornata, somministrando gli analoghi rapidi ogni 4 ore oppure l’insulina rapida regolare ogni 6 ore. Se l’alimentazione viene effettuata a intervalli durante il giorno, si imposta sempre l’insulina basale e l’insulina analogo o rapida regolare con gli intervalli di 4-6 ore, avendo cura di cessare la somministrazione insulinica nell’intervallo prima della sospensione. Infine, se la nutrizione viene effettuata a boli intervallati, verrà somministrata solo insulina analogo o rapida regolare in corrispondenza del bolo alimentare. In corso di nutrizione parenterale totale, l’insulina deve essere somministrata in parallelo alla sacca nutrizionale per evitare che possa precipitare e essere inattivata. Il fabbisogno viene calcolato in base alla quantità di carboidrati presenti e allo stato del paziente e deve essere modificato in base ai livelli glicemici (1-2, 4).
Terapia CSII. Al momento del ricovero in ospedale per eventi acuti, i pazienti in terapia insulina sottocutanea in continuo con microinfusore passano generalmente all’infusione endovenosa o allo schema sottocutaneo basal-bolus, a seconda del livello di criticità. Infatti, da un lato, il personale sanitario non di area diabetologica non possiede le competenze necessarie per gestire una terapia così complessa e, dall’altro, il paziente, pur se formato, non è in grado di auto-gestirsi in presenza condizioni patologiche intercorrenti. Nel caso in cui fosse presente un Centro Diabetologico, tale modalità terapeutica potrebbe essere mantenuta, ma solamente nei casi con basso livello di criticità (51). Il passaggio alla terapia sottocutanea basal-bolus prevede o il mantenimento dello stesso dosaggio insulinico, in caso di buon compenso precedentemente al ricovero e bassa criticità, o una riduzione del 20% del fabbisogno basale, in caso di alto rischio di ipoglicemia, lasciando invariati i boli prandiali (43).
Conclusioni
Come è stato illustrato, la terapia insulinica rappresenta il gold standard nel trattamento dell’iperglicemia acuta in regime ospedaliero. Il dosaggio deve essere modulato in modo da ottenere l’obiettivo glicemico, evitando l’ipoglicemia e riducendo la variabilità glicemica. In condizioni critiche, la somministrazione di insulina viene effettuata per via endovenosa secondo algoritmi specifici, mentre in condizioni non critiche l’insulina viene somministrata per via sottocutanea, con schemi specifici e modulando il dosaggio impostato in base ai valori glicemici rilevati. Solo ed esclusivamente i soggetti in condizioni non critiche e stabili dal punto di vista glicemico possono proseguire la terapia domiciliare, anche se molto spesso le condizioni del paziente e la malattia acuta che ha causato il ricovero in ospedale ne impediscono il proseguimento, per i possibili effetti avversi e l’interazione con altre terapie in atto.
La complessa interazione descritta tra insulina, glucagone, epinefrina e cortisolo, alla base dell’iperglicemia acuta in condizioni critiche, potrebbe però aprire una finestra su nuovi approcci terapeutici (6). Gli agonisti del recettore del GLP-1 (GLP1- RA) e gli inibitori della Dipeptidil Peptidasi 4 (DPP-4 i) sono in grado di modulare la secrezione di glucagone, responsabile dell’iperglicemia, senza causare ipoglicemia. Attualmente, sono ancora pochi gli studi condotti in ambito ospedaliero per la gestione dell’iperglicemia in condizioni critiche con queste molecole ed è prematuro inserirli nella pratica quotidiana, in quanto non è ancora stata chiarita la sicurezza a lungo termine. Inoltre, i GLP1-RA, proprio per il loro meccanismo d’azione, comportano un rallentamento dello svuotamento gastrico, con nausea e vomito, condizioni queste che interferiscono con la cinetica degli altri farmaci concomitanti (52). Un’altra ipotesi riguarda la possibilità di utilizzare agonisti del recettore del glucagone allo scopo di ridurre i livelli di ormone circolante, riducendo così l’iperglicemia senza il rischio di ipoglicemia. I primi studi, però, hanno riportato anche un incremento dei livelli di colesterolo LDL e degli enzimi epatici, reversibili con la sospensione del farmaco. Sono anche in corso studi preclinici per valutare la farmacocinetica e la farmacodinamica di anticorpi monoclonali contro il recettore del glucagone, nei quali è stato dimostrato un effetto protratto sulla riduzione della glicemia e della produzione epatica di glucosio in animali diabetici (6). Ovviamente queste ipotesi sono ad oggi speculative e necessitano di evidenze più convincenti.
Da ultimo, è necessario sottolineare che, al momento della dimissione, qualora il paziente dovesse proseguire la terapia insulinica, è fondamentale che il personale sanitario imposti un programma educativo affinché il paziente stesso possa autogestire la terapia domiciliare in sicurezza (1-2).
Bibliografia
1. American Diabetes Association. Standards of Medical Care in Diabetes. Diab Care 39(1), 2016.
2. Associazione Medici Diabetologi – Società Italiana di Diabetologia. Standard Italiani per la Cura del Diabete Mellito. Infomedica, 2014.
3. Wexler DJ, Nathan DM, Grant RW et al. Prevalence of elevated hemoglobin A1c among patients admitted to the hospital without a diagnosis of diabetes. J Clin Endocrinol Metab 93(11): 4238-4244, 2008.
4. Umpierrez GE, Hellman R, Korytkowski MT et al. Management of hyperglycemia in hospitalized patients in non-critical care setting: an endocrine society clinical practice guideline. J Clin Endocrinol Metab 97: 16-38, 2012.
5. Cook CB, Kongable GL, Potter DJ et al. Inpatient glucose control: a glycemic survey of 126 U.S. hospitals. J Hosp Med 4(9): E7-E14, 2009.
6. Harp JB, Yancopopoulos GD, Gromada J. Glucagon orchestrates stress-induced hyperglycaemia. Diabetes Obes Metab 18(7): 648-653, 2016.
7. Umpierrez GE, Isaacs SD, Bazargan N, You X, Thaler LM, Kitabchi AE. Hyperglycemia: an independent marker of in-hospital mortality in patients with undiagnosed diabetes. J Clin Endocrinol Metab 87: 978-982, 2002.
8. Krinsley JS. Association between hyperglycemia and increased hospital mortality in a heterogeneous population of critically ill patients. Mayo Clinic Proc 78: 1471-1478, 2003.
9. Dungan KM, Braithwaite SS, Preiser JC. Stress hyperglycaemia. Lancet 373: 1798-1807, 2009.
10. Capes SE, Hunt D, Malmberg K, Gerstein HC. Stress hyperglycaemia and increased risk of death after myocardial infarction in patients with and without diabetes: a systematic overview. Lancet 355: 773-778, 2000.
11. Palermo NE, Gianchandani RY, McDonnel ME et al. Stress hyperglycemia during surgery and anesthesia: pathogenesis and clinical implications. Curr Diab Rep 16(3): 33, 2016.
12. Cooperberg BA, Cyer PE. Insulin reciprocally regulates glucagon secretion in humans, Diabetes 59: 2936-2940, 2010.
13. Dunser MW, Hasibeder WR. Sympathetic overstimulation during critical illness: adverse effects of adrenergic stress. J Intensive care Med 24: 293-316, 2009.
14. van den Berghe G, Wouters P, Weekers F. Intensive insulin therapy in critically ill patients. N Engl J Med 345: 1359-1367, 2001.
15. Kosiborod M, Inzucchi SE, Krumholz HM et al. Glucose normalization and outcomes in patients with acute myocardial infarction. Arch Intern Med 169: 438-446, 2009.
16. Capes SE, Hunt D, Malmberg K, Pathak P, Gerstein HC. Stress hyperglycemia and prognosis of stroke in nondiabetic and diabetic patients: a systematic overview. Stroke 32: 2426-2432, 2001.
17. Tagher G, Dauriz M, Tavazzi L et al. Prognostic impact of in-hospital hyperglycemia in hospitalized patients with acute heart failure: Resul of the IN-HF (Italian Network on Heart failure) Outcome registry. Int J Cardiol 15(203): 587-593, 2016.
18. Krinsley JS. Glycemic control, diabetes status, and mortality in a heterogeneous population of critically ill patients before and during the era of intensive management: six and one half years experience at a university-affiliated community hospital. Semin Thorac Cardiovasc Surg 18(4): 317-325, 2006.
19. Krinsley JS. Effect of an intensive glucose management protocol on the mortality of critically ill adult patients. Mayo Clin Proc 79(8): 992-1000, 2004.
20. Finfer S, Chittock DR, Su SY et al. Intensive versus conventional glucose control in critically ill patients. N Engl J Med 360: 1283-1297, 2009.
21. NICE-SUGAR Study Investigation. Hypoglycemia and risk of death in critically ill patients. N Engl J Med 367: 1108-1118, 2012.
22. Svensson AM, McGuire DK, Abrahamsson P et al. Association between hype- and hypoglycaemia and 2 year all-cause mortality risk in diabetic patients with coronary events. Eur Heart J 26: 1255-1261, 2005.
23. Egi M, Bellomo R, Stachowski E et al. Hypoglycemia and outcome in critically ill patients. Mayo Clin Proc 85: 217-224, 2010.
24. Krinsley JS, Bruns DE, Boyd JC. The impact of measurement frequency on the domains of glycemic control in the critically ill: A Monte Carlo simulation. J Diab Sci Tech 9: 1-9, 2015.
25. Egi M, Bellomo R, Stachowski Ee t al. Variability of blood glucose concentration and short term mortality in the critically ill patients. Anesthesiology 105: 244-252, 2006.
26. Krinsley JS. Glycemic variability. A strong independent predictor of mortality in critically ill patients. Crit Care Med 36: 3008-3013, 2008.
27. Ali NA, O’Brien JM Jr, Dungan K et al. Glucose variability and mortality in patients with sepsis. Crit Care Med 36: 2316-2321, 2008.
28. Falciglia M, Freyberg RW, Almenoff PL et al. Hyperglycemia-related mortality in critically ill patients varies with admission diagnosis. Crit Care Med 37: 3001-3009, 2009.
29. Kotagal M, Symons RG, Hirsh IB et al. SCOAP-CERTAIN collaborative perioperative hyperglycemia and risk of adverse events among patients with and without diabetes. Ann Surg 261(1): 97-103, 2015.
30. Umpierrez G, Cardona S, Pasquek F et al. Randomized controlled trial of intensive versus conservative glucose controlin patients undergoing coronary artery bypass graft surgery: GLUCO-CABG trial. Diabetes Care 38(9): 1665-1672, 2015.
31. Moghissi ES. Reexamining the evidence for inpatient glucose control: new recommendations for glycemic targets. Am J Health Syst Pharm 67(16 Suppl 8): S3-8, 2010.
32. Krinsley JS. Glycemic control in the critically ill: what have learned since NICE-SUGAR? Hosp Practic 43(3): 191-197, 2015.
33. Krinsley JS, Bruns DE, Boyd JC. The impact of measurement frequency on the domains of glycemic control in the critically ill–a Monte Carlo simulation. J Diabetes Sci Technol 9(2): 237-245, 2015.
34. Clement S, Braithwaite SS, Magee MF et al. Management of diabetes and hyperglycemia in hospitals. Diabetes Care 27(2): 553-591, 2004.
35. Goldberg PA, Roussel MG, Inzucchi SE. Clinical results of an updated insulin infusion protocol in critically ill patients. Diabetes Spectrum 18: 188-191, 2005.
36. Shetty S, Inzucchi SE, Goldberg PA, et al. Adapting to the new consensus guidelines for managing hyperglycemia during critical illness: the reported Yale Infusion protocol. Endocr Pract 18: 363-370, 2012.
37. Braithwaite SS, Clement S. Algorithms for intravenous insulin delivery. Curr Diabetes Rev 4(3): 258-268, 2008.
38. Bloomgarden Z, Mechanick JI. Acute glycemic control in hospitalized patients: evidence published since the American College of Endocrinology Position Statement. Insulin 2: 12-23, 2007.
39. Malmberg K, Ryden L, Efendic S et al. Randomized trial of insulin-glucose infusion followed by subcutaneous insulin treatment in diabetic patients with acute myocardial infarction (DIGAMI study): effects on mortality at 1 year. J Am Coll Cardiol 26: 57-65, 1995.
40. Malmberg K, Rydén L, Wedel H (DIGAMI 2 Investigators). Intense metabolic control by means of insulin in patients with diabetes mellitus and acute myocardial infarction (DIGAMI 2): effects on mortality and morbidity. Eur Heart J 26(7): 650-661. 2005.
41. Markovitz LJ1, Wiechmann RJ, Harris N et al. Description and evaluation of a glycemic management protocol for patients with diabetes undergoing heart surgery. Endocr Pract 8(1): 10-18, 2002.
42. Beltramello G, Manicardi V, Trevisan R. Managing Hyperglycemia in internal medicine: instructions for use. Acta Diabetol 50: 465-473, 2013.
43. Bruttomesso D. Terapia insulinica. In: Società Italiana di Diabetologia. La gestione della persona con diabete ricoverata per altra patologia. Bologna, Bononia University Press, pp. 47-68, 2016.
44. Moghissi ES, Korytkowski MT, Di Nardo M, et al. American Association of Clinical Endocrinologists; American Diabetes Association. American Association of Clinical Endocrinologists and American Diabetes Association consensus statement on inpatient glycemic control. Diabetes Care 32(6): 1119-1131, 2009.
45. Umpierrez GE, Smiley D, Zisman A et al. Randomized study of basal-bolus insulin therapy in the inpatient management of patients with type 2 diabetes (RABBIT 2 Trial). Diabetes Care 30: 2181-2186, 2007.
46. Umpierrez GE, Smiley D, Jacobs S et al. Randomized study of basal-bolus insulin therapy in the inpatient management of patients with type 2 diabetes undergoing general surgery (RABBIT 2 surgery). Diabetes Care 34(2): 256-261, 2011.
47. Lee S, Eng C. Goals of glycemic control in frail older patients with Diabetes JAMA 305: 1350-1351, 2011.
48. Mak RH. Impact of end-stage renal disease and dialisi on glycemic control. Sem Dial 13: 4-8, 2000.
49. Baldwin D, Apel J. Management of hyperglycemia in hospitalized patients with renal insufficiency or steroid-induced diabetes. Curr Diab Rep 13: 114-120, 2013.
50. Low Wang CC, Draznin B. Pratical approach to management of inpatients hyperglycemia in select patient populations. Hospital practice 4: 45-53, 2013.
51. Kannan S, Satra A, Calogeras E et al. Insulin pump patient characteristics and glucose control in the hospitalized setting. J Diabetes Sci Technol 8(3): 473-478, 2014.
52. Umpierrez GE, Gianchandani R, Smiley D et al. Safety and efficacy of sitagliptin therapy for the inpatient management of general medicine and surgery patients with type 2 diabetes: a pilot, randomized, controlled study. Diabetes Care 36(11): 3430-3435, 2013.
[/protected]