Rubrica Opinioni a Confronto a cura di Anna Solini1, Agostino Consoli2
1Dipartimento di Medicina Clinica e Sperimentale, Università degli Studi di Pisa; 2Dipartimento di Medicina e Scienze dell’Invecchiamento, Università degli Studi di Chieti-Pescara “G. D’Annunzio”
Pioglitazone: è ora di cominciare finalmente ad usarlo o è tempo di dimenticarlo del tutto?
DISCUSSANT
Matteo Monami
Cardiologia e Medicina Geriatrica – DAI Medico Geriatrico, Azienda Ospedaliero-Universitaria Careggi, Firenze
> Scarica l’articolo in formato PDF
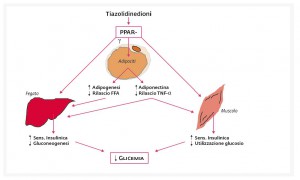
- Meccanismi d’azione
Il pioglitazone, in molti paesi ultima molecola ancora in commercio della classe degli agonisti del Peroxisome Proliferator-Associated Receptor γ (PPAR-γ), esplica le sue azioni biologiche legandosi al proprio recettore, che riconosce come i ligandi endogeni alcuni prostanoidi derivati dall’acido arachidonico. Il recettore PPAR-γ è presente in numerosi tipi cellulari, con profili di azione differenziati da un tessuto all’altro. Complessivamente, i geni la cui espressione viene stimolata o, più raramente, inibita dagli agonisti PPAR-γ sono oltre 600, molti dei quali ancora ignoti. Tra le proteine la cui sintesi viene stimolata dall’attivazione del PPAR-γ ce ne sono molte coinvolte nel metabolismo del glucosio e nel signaling intracellulare dell’insulina, quali gli Insulin Receptor Substrates (IRS) 1 e 2, il glucotrasportatore insulino-dipendente GLUT-4 (1). Uno dei tessuti in cui i recettori PPAR-γ sono maggiormente rappresentati è il tessuto adiposo, che è forse il principale organo bersaglio dei tiazolidinedioni. Infatti, sebbene gli adipociti contribuiscano in maniera relativamente modesta alla metabolizzazione del glucosio, essi modulano le funzioni metaboliche del fegato e del muscolo scheletrico attraverso segnali sia endocrini, che metabolici. I tiazolidinedioni, capaci di stimolare la differenziazione adipocitaria e l’accumulo di trigliceridi nel tessuto adiposo, riducono la liberazione di acidi grassi liberi; ciò contribuisce alla riduzione della gluconeogenesi epatica ed all’aumento della sensibilità insulinica muscolare. Inoltre, i tiazolidinedioni inibiscono la produzione adipocitaria di TNF-α (che induce insulino-resistenza) e stimolano quella di adiponectina (che ha azione insulino-sensibilizzante ed inibente la liberazione di mediatori della flogosi a livello endoteliale) (1). Il meccanismo d’azione dei tiazolidinedioni è riassunto nella figura 1.
- Effetti ipoglicemizzanti
Pro
L’effetto terapeutico del pioglitazone, come detto, è dovuto alla sua azione insulino-sensibilizzante, non associata ad alcuna diretta stimolazione della secrezione di insulina; questo comporta un miglioramento del compenso glucometabolico, senza aumentare il rischio ipoglicemico, a differenza di altri farmaci quali gli insulino-secretagoghi (1). I tiazolidinedioni sono in grado di ridurre efficacemente la glicemia a digiuno e, in misura assai meno marcata, le escursioni glicemiche post-prandiali, provocando di conseguenza una riduzione dell’emoglobina glicata (2-3). In modelli sperimentali animali, durante trattamenti protratti, i tiazolidinedioni hanno mostrato una spiccata capacità inibente l’apoptosi delle cellule insulino-secernenti del pancreas, aumentandone sia la massa che la funzione endocrina (4). Nell’uomo tali interessanti azioni sono ancora da dimostrare, anche se nello studio ADOPT (2), il rosiglitazone si è mostrato capace di mantenere più a lungo un buon controllo metabolico, rispetto alla glibenclamide ed alla metformina. Questo fenomeno, noto con il termine di durability, potrebbe essere attribuibile ad un effetto protettivo del farmaco a livello beta-cellulare nel paziente diabetico di tipo 2, anche se va ricordato che le sulfaniluree tendono nel tempo a peggiorare la funzione di tali cellule, potendo amplificare le differenze ottenute in questo studio (2). In questo senso, l’uso del pioglitazone potrebbe realmente avere effetti benefici nel ritardare il declino della secrezione insulinica, riducendo così la probabilità di dover ricorrere ad ulteriori farmaci, inclusi l’insulina esogena, per mantenere un adeguato controllo glicometabolico (5).
Contro
Rispetto ad altri farmaci, come le sulfaniluree, i tiazolidinedioni hanno un effetto ipoglicemizzante meno rapido: i loro effetti terapeutici, infatti, sulla glicemia si rendono pienamente evidenti dopo diverse settimane dall’inizio del trattamento (3). Ciò spiega perché, nei trial clinici, l’effetto sull’emoglobina glicata a 3-6 mesi sia spesso inferiore rispetto a quello delle sulfaniluree o di altri farmaci (3). Prolungando, tuttavia, il periodo di osservazione e di trattamento, questo differenziale si riduce fino ad invertirsi a favore dei tiazolidinedioni nei trial di durata superiore ad un anno (3, 6).
- Altri effetti metabolici
Pro
Il pioglitazone, principalmente grazie alla azione insulino-sensibilizzante, è in grado di ridurre i livelli circolanti di trigliceridi e di aumentare quelli di colesterolo HDL, riducendo, inoltre, la pressione arteriosa. Tutte queste azioni intrinseche del pioglitazone potrebbero contribuire a ridurre il rischio cardiovascolare dei pazienti con diabete di tipo 2, in maniera indipendente dall’effetto ipoglicemizzante (7).
Contro
Un altro effetto metabolico del pioglitazone che, invece, potrebbe dare risultati negativi sul rischio cardiovascolare è costituito dall’aumento, seppur modesto, del colesterolo totale e della frazione LDL (8). Occorre però tenere presente che la terapia con pioglitazione tende a far aumentare le dimensioni delle particelle di LDL, riducendo la percentuale di quelle piccole e dense, che sono più fortemente aterogene. L’aumento del colesterolo LDL che ne risulta sembra, quindi, associato ad una riduzione del rischio cardiovascolare, piuttosto che ad un aumento (9), anche se tali considerazioni sono del tutto speculative e da dimostrare. Altro effetto potenzialmente deleterio sul rischio complessivo di malattie cardiovascolari incidenti è quello legato al peso corporeo. È noto che pioglitazone determina come effetto collaterale un significativo incremento ponderale (10). Questo è dovuto, in parte, alla ritenzione idrica (vedi oltre), ed in parte all’aumento della massa adiposa osservati durante il trattamento prolungato con il farmaco (10). Infatti, il pioglitazone, ed in generale i tiazolidinedioni, stimolano l’appetito, senza modificare il dispendio energetico, favorendo la deposizione di trigliceridi nel tessuto adiposo. I tiazolidinedioni, tuttavia, inducono una redistribuzione generale dell’adipe, incrementando il tessuto adiposo sottocutaneo senza aumentare quello viscerale (come noto, più deleterio dal punto di vista metabolico e del rischio cardiovascolare), che risulta così immodificato o addirittura ridotto (11). Uno schema riassuntivo degli effetti metabolici dei tiazolidinedioni è riportato nella Tabella 1.
- Complicanze microvascolari e macrovascolari e mortalità
Lo scopo del trattamento a lungo termine della terapia ipoglicemizzante è quello di ridurre l’incidenza di complicanze micro- e macrovascolari del diabete e, in ultima istanza, la mortalità.
Pro
Riguardo alle complicanze microvascolari, ci si attende che una terapia molto efficace nel tempo sull’iperglicemia, come quella con tiazolidinedioni, abbia un effetto assai favorevole. Inoltre, esistono dati preliminari, da confermare, su un possibile effetto anti-microalbuminurico dei tiazolidinedioni, anche indipendentemente dall’azione ipoglicemizzante (12). Questa potenziale azione nefroprotettiva, che sarebbe dovuta agli effetti antinfiammatori dei tiazolidinedioni, necessita però di ulteriori conferme attraverso trial di maggiori dimensioni appositamente disegnati. Riguardo agli effetti sul rischio cardiovascolare, abbiamo ricordato in precedenza che i tiazolidinedioni agiscono in maniera favorevole su vari fattori di rischio (Tab. 1);
inoltre, possiedono specifiche azioni antinfiammatorie, che potrebbero contribuire alla prevenzione dell’aterogenesi (13). Trial di confronto diretto con le sulfaniluree mostrano che i tiazolidinedioni, a parità di controllo metabolico, sono più efficaci nella prevenzione della progressione dello spessore dell’intima-media carotidea (7, 14). Quest’ultimo parametro viene generalmente considerato un buon predittore degli eventi cardiovascolari. Peraltro, l’effetto complessivo sul rischio cardiovascolare complessivo di qualsiasi farmaco deve essere valutato sulla base degli eventi maggiori osservati nel corso dei trial randomizzati, contro placebo o contro altri farmaci ipoglicemizzanti. Il trial di riferimento per il pioglitazone è lo studio PROACTIVE con specifici endpoint cardiovascolari (15). Nello studio PROACTIVE, condotto in pazienti ad alto rischio, il pioglitazone, rispetto al placebo, produce, come noto, una tendenziale riduzione della morbilità e mortalità cardiovascolare, che peraltro non raggiunge la significatività statistica. Analoghi risultati (di tendenziale riduzione del rischio cardiovascolare) si osservano negli altri studi di minori dimensioni condotti con il pioglitazone, come dimostrato da una metanalisi di trial clinici nella quale vi era una tendenziale riduzione degli eventi cardiovascolari maggiori e della mortalità da tutte le cause nei confronti di placebo o altri farmaci ipoglicemizzanti (16). Una serie di trial clinici di piccole dimensioni, condotte anche in pazienti non diabetici, ha dimostrato come, sia il pioglitazone che il rosiglitazone, siano in grado di prevenire la restenosi dopo angioplastica coronarica con stent (13). È verosimile che l’azione antinfiammatoria dei tiazolidinedioni (17) abbia una rilevanza maggiore nella prevenzione della restenosi, che è fenomeno prevalentemente flogistico, rispetto all’aterogenesi.
Contro
Nel complesso, tuttavia, gli studi sugli effetti dei tiazolidinedioni, e quindi del pioglitazone, sul rischio cardiovascolare appaiono abbastanza inconcludenti: nonostante gli effetti favorevoli su alcuni fattori di rischio e la nota azione antiinfiammatoria, gli agonisti PPAR-γ non sembrano avere alcuna azione specificamente protettiva nei confronti degli eventi cardiovascolari in generale, e della malattia coronarica in particolare (15-16). È possibile che l’effetto cardiovascolare sia diverso in sottogruppi specifici di pazienti. I dati fino ad oggi disponibili indicano che i tiazolidinedioni potrebbero avere un profilo meno favorevole quando vengono utilizzati in pazienti francamente obesi, oppure combinati con l’insulina (18); invece, la loro azione cardiovascolare potrebbe essere maggiormente favorevole nei pazienti con ipertrigliceridemia (18). Ulteriori studi ed analisi per sottogruppo di trial clinici randomizzati potrebbero definire con maggior precisione le caratteristiche dei pazienti che possono trarre il massimo beneficio sul piano cardiovascolare dal trattamento con tiazolidinedioni, ma questo tipo di analisi raramente vengono pubblicate. Un altro effetto negativo da considerare con pioglitazone è costituito dall’aumento del rischio di ricoveri per scompenso cardiaco, che è un effetto collaterale da tenere in considerazione durante una terapia con pioglitazone (16). Questo fenomeno non è dovuto ad una azione cardiaca diretta del farmaco, ma soltanto alla ritenzione idrica da questo indotta, che può rendere clinicamente manifesta una disfunzione cardiaca precedentemente silente. Gli agonisti del PPAR-γ, infatti, agiscono sul rene a livello del tubulo distale, favorendo il riassorbimento dell’acqua e dei sali minerali (19); ne risulta una espansione del volume dei liquidi extracellulari che contribuisce all’aumento di peso e che può provocare, in alcuni pazienti, edemi declivi. La semplice presenza di edemi alle caviglie non è comunque un motivo sufficiente per sospendere il farmaco; l’effetto collaterale può essere facilmente controllato con una bassa dose di diuretico risparmiatore di potassio (canrenoato o spironolattone 25 mg/die) (20). Qualora sia presente una disfunzione cardiaca, l’espansione della volemia ed il sovraccarico di volume possono, tuttavia, precipitare i sintomi dello scompenso cardiaco (16) e per tale motivo il farmaco è controindicato in pazienti con disfunzione ventricolare, anche se in classe NYHA I. Questo rischio è maggiore quando i pazienti ricevono i tiazolidinedioni in combinazione con l’insulina e pertanto tale associazione deve essere considerata con grande cautela (16, 18).
- Carcinogenesi
Negli ultimi anni, il rapporto tra terapie ipoglicemizzanti e carcinogenesi è stato ampiamente studiato e dibattuto per numerose molecole, tra le quali metformina, sulfaniluree, insulina e recentemente anche per pioglitazone. Per quanto riguarda il pioglitazone, esistono pochi studi epidemiologici, che forniscono risultati molto divergenti tra loro; in alcuni casi non vi sarebbe alcun segnale né positivo, né negativo, in altri invece il farmaco potrebbe addirittura ridurre il rischio tumorale, almeno per alcuni tipi di neoplasia (21-25). L’interpretazione di studi clinici epidemiologici sulle possibili correlazioni (positive o negative) tra farmaci ed eventi avversi (soprattutto se rari) è quasi sempre problematico, in particolar modo per i possibili bias di selezione e prescrizione (pazienti che ricevono un farmaco, invece che un altro, in assenza di randomizzazione, possono avere caratteristiche cliniche diverse) non sempre aggiustabili con tecniche statistiche. Di contro, i trial randomizzati non hanno questo problema, ma non sono disegnati per questo specifico scopo (differenze nella carcinogenesi tra diversi trattamenti) e spesso arruolano casistiche limitate, relativamente giovani e poco complicate.
Pro
A favore dell’ipotesi che pioglitazone, ed in generale i tiazolidinedioni, possano avere effetti benefici sulla carcinogenesi, vi sono numerosi studi preclinici e su modelli animali, che mostrano un’azione inibente la proliferazione cellulare del farmaco (26-27). Gli studi epidemiologici mostrano invece, come detto, risultati contraddittori e non chiari dei glitazoni nei confronti dei tumori (21). L’unica modalità possibile per evidenziare una eventuale correlazione tra pioglitazone e carcinogenesi è quella di ricavare informazioni da trial clinici attraverso metodiche metanalitiche. Esistono due metanalisi sull’argomento, che mostrano risultati rassicuranti sia per il pioglitazone che per il rosiglitazone (28-29); quando analizzati, come classe di farmaci (pioglitazone insieme a rosiglitazone) nei confronti di placebo o altri farmaci attivi, mostrano una riduzione statisticamente significativa di circa il 30% dell’incidenza di tumori per tutte le cause (in particolare i tumori estrogeno dipendenti) (28).
Contro
Alcuni studi epidemiologici hanno recentemente sollevato alcuni dubbi in termini di sicurezza di pioglitazone nei confronti del tumore della vescica (30-31). Questi risultati, in linea con quelli ottenuti da alcuni trial clinici randomizzati (32-33), hanno comportato alcuni warning da parte delle autorità regolatorie nazionali ed internazionali, che in alcuni casi hanno portato alla sospensione del farmaco (come ad esempio in Francia). Come detto, tuttavia, l’unico modo possibile per affrontare il problema è attraverso tecniche metanalitiche. In una delle due metanalisi prima citate, a fronte di un risultato positivo per pioglitazone con una riduzione del rischio tumorigeno generale, vi sarebbe nella sotto-analisi che riguarda i tumori della vescica, un segnale di aumentato rischio, che tuttavia non raggiunge la significatività statistica (28).
- Fratture ossee
Pro
Nessuno.
Contro
Un effetto collaterale noto dei tiazolidinedioni in generale è rappresentato dalla riduzione della densità ossea, in particolare nelle donne in post-menopausa (34); tale effetto è da imputare principalmente alla differenziazione in senso adipocitario di cellule staminali multipotenti presenti all’interfaccia tra tessuto osseo e grasso midollare e capaci, in condizioni normali, di generare osteoblasti (35). Di conseguenza, durante trattamento con tiazolidinedioni, si ha una riduzione dell’osteogenesi e, a lungo andare, della densità ossea che comporta un aumento del rischio delle fratture ossee (36). È perciò prudente, nelle donne in post-menopausa trattate con tiazolidinedioni, fornire anche un supplemento di calcio ed eventualmente di vitamina D, utile anche per prevenire eventuali deficit alimentari indotti dalla restrizione spesso imposta, nei pazienti diabetici, dell’assunzione di grassi saturi.
CONCLUSIONI
In conclusione, pioglitazone è un farmaco che possiede una potente azione insulino-sensibilizzante ed ipoglicemizzante a lungo termine, senza aumentare il rischio di ipoglicemia e con possibili effetti protettivi sulla beta cellula. Tra l’altro, va ricordato come fino ad oggi esistono pochissimi farmaci orali attivi sull’iperglicemia a digiuno ed il pioglitazone rappresenta una valida opzione terapeutica in pazienti con prevalente alterazione della glicemia a digiuno. Inoltre, i possibili effetti cardioprotettivi (riduzione della frazione LDL aterogena, aumento del colesterolo HDL, ridistribuzione del grasso corporeo, diminuzione della pressione arteriosa ecc.), grazie alla sua azione antinfiammatoria ed una possibile azione anti-tumorale nei confronti dei tumori estrogeno-dipendenti, lo rendono un farmaco sicuramente molto interessante. Non possono, altresì, essere dimenticati gli effetti collaterali legati all’uso di questo farmaco e che sono molto evidenti in alcuni sotto gruppi di pazienti. In particolar modo, l’aumento di peso e di ritenzione idrica (possibile concausa di scompenso cardiaco, specie in pazienti con grave obesità ed in trattamento con insulina), di fratture ossee (soprattutto nelle donne in età post-menopausale) e di tumori vescicali (in pazienti con fattori di rischio pre-esistenti) sono fattori limitanti l’uso di pioglitazone in maniera estensiva. In definitiva, pioglitazone è un farmaco che può e deve continuare a far parte dell’armamentario del diabetologo, ma vanno attentamente valutati i rischi ed i benefici, scegliendo accuratamente il paziente da trattare, anche alla luce dei nuovi farmaci ipoglicemizzanti che hanno profili di sicurezza sicuramente più interessanti.
BIBLIOGRAFIA
1. Tonelli J, Li W, Kishore P, et al. Mechanisms of early insulin-sensitizing effects of thiazolidinediones in type 2 diabetes. Diabetes 53: 1621-1629, 2004.
2. Kahn SE, Haffner SM, Heise MA et al. Glycemic durability of rosiglitazone, metformin, or glyburide monotherapy. N Engl J Med 355: 2427-2443, 2006.
3. Charbonnel BH, Matthews DR, Schernthaner G, et al. A long-term comparison of pioglitazone and gliclazide in patients with Type 2 diabetes mellitus: a randomized, double-blind, parallel-group comparison trial. Diabet Med 22: 399-405, 2005.
4. Zeender E, Maedler K, Bosco D, et al. Pioglitazone and sodium salicylate protect human beta-cells against apoptosis and impaired function induced by glucose and interleukin-1beta. Clin Endocrinol Metab 89: 5059-5066, 2004.
5. Matthews DR, Cull CA, Stratton IM, et al. UKPDS 26: Sulphonylurea failure in non-insulin-dependent diabetic patients over six years. UK Prospective Diabetes Study (UKPDS) Group. Diabet Med 15: 297-303, 1998.
6. Phung OJ, Scholle JM, Talwar M, et al. Effect of noninsulin antidiabetic drugs added to metformin therapy on glycemic control, weight gain, and hypoglycemia in type 2 diabetes. JAMA 303: 1410-1418, 2010.
7. Nissen SE, Nicholls SJ, Wolski K, et al. Comparison of pioglitazone vs glimepiride on progression of coronary atherosclerosis in patients with type 2 diabetes: the PERISCOPE randomized controlled trial. JAMA 299: 1561-1573, 2009.
8. Monami M, Vitale V, Ambrosio ML, et al. Effects on lipid profile of dipeptidyl peptidase 4 inhibitors, pioglitazone, acarbose, and sulfonylureas: meta-analysis of placebo-controlled trials. Adv Ther 29: 736-746, 2012.
9. Genovese S, Passaro A, Brunetti P, et al. Pioglitazone Randomised Italian Study on Metabolic Syndrome (PRISMA): effect of pioglitazone with metformin on HDL-C levels in Type 2 diabetic patients. J Endocrinol Invest 36: 606-616, 2013.
10. Chilcott J, Tappenden P, Jones ML, et al. A systematic review of the clinical effectiveness of pioglitazone in the treatment of type 2 diabetes mellitus. Clin Ther 23: 1792-1823, 2001.
11. Miyazaki Y, Mahankali A, Matsuda M, et al. Effect of pioglitazone on abdominal fat distribution and insulin sensitivity in type 2 diabetic patients. Clin Endocrinol Metab 87: 2784-2791, 2002.
12. Sarafidis PA, Stafylas PC, Georgianos PI, et al. Effect of thiazolidinediones on albuminuria and proteinuria in diabetes: a meta-analysis. Am J Kidney Dis 55: 835-847, 2010.
13. Geng DF, Jin DM, Wu W, et al. Effect of thiazolidinediones on in-stent restenosis in patients after coronary stenting: a meta-analysis of randomized controlled trials. Atherosclerosis 202: 521-528, 2009.
14. Mazzone T, Meyer PM, Feinstein SB, et al. Effect of pioglitazone compared with glimepiride on carotid intima-media thickness in type 2 diabetes: a randomized trial. JAMA 296: 2572-2581, 2006.
15. Dormandy JA, Charbonnel B, Eckland DJ, et al. Secondary prevention of macrovascular events in patients with type 2 diabetes in the PROactive Study (PROspective pioglitAzone Clinical Trial In macroVascular Events): a randomised controlled trial. Lancet 366: 1279-1289, 2005.
16. Mannucci E, Monami M, Lamanna C, et al. Pioglitazone and cardiovascular risk. A comprehensive meta-analysis of randomized clinical trials. Diabetes Obes Metab 10: 1221-1238, 2008.
17. Sobel BE, Hardison RM, Genuth S, et al. Profibrinolytic, antithrombotic, and antiinflammatory effects of an insulin-sensitizing strategy in patients in the Bypass Angioplasty Revascularization Investigation 2 Diabetes (BARI 2D) trial. Circulation 124: 695-703, 2011.
18. Monami M, Marchionni N, Mannucci E. Winners and losers at the rosiglitazone gamble A meta-analytical approach at the definition of the cardiovascular risk profile of rosiglitazone. Diabetes Res Clin Pract 82: 48-57, 2008.
19. Panchapakesan U, Pollock C, Saad S. Review article: importance of the kidney proximal tubular cells in thiazolidinedione-mediated sodium and water uptake. Nephrology 14: 298-301, 2009.
20. Viswanathan V, Mohan V, Subramani P, et al. Effect of spironolactone and amiloride on thiazolidinedione-induced fluid retention in South Indian patients with type 2 diabetes. Clin J Am Soc Nephrol 8: 225-232, 2013.
21. Koro C, Barrett S, Qizilbash N. Cancer risks in thiazolidinedione users compared to other anti-diabetic agents. Pharmacoepidemiol. Drug Saf 16: 485-492, 2007.
22. Monami M, Lamanna C, Marchionni N, et al. Rosiglitazone and risk of cancer: a meta-analysis of randomized clinical trials. Diabetes Care 31: 1455-1460, 2008.
23. Govindarajan R, Ratnasinghe L, Simmons DL, et al. Thiazolidinediones and the risk of lung, prostate, and colon cancer in patients with diabetes. J Clin Oncol 25: 1476-1481, 2007.
24. Ramos-Nino ME, MacLean CD, Littenberg B. Association between cancer prevalence and use of thiazolidinediones: results from the Vermont Diabetes Information System. BMC. Med 5: 17, 2007.
25. Ferrara A, Lewis JD, Quesenberry CP Jr, et al. Cohort study of pioglitazone and cancer incidence in patients with diabetes. Diabetes Care 34: 923-929, 2011.
26. Wei S, Yang J, Lee SL, et al. PPARgamma-independent antitumor effects of thiazolidinediones. Cancer Lett 276: 119-124, 2009.
27. Okumura T: Mechanisms by which thiazolidinediones induce anti-cancer effects in cancers in digestive organs. J Gastroenterol 45: 1097-1102, 2010.
28. Monami M, Dicembrini I, Mannucci E. Thiazolidinediones and cancer: results of a meta-analysis of randomized clinical trials. Acta Diabetol 51: 91-101, 2014.
29. Monami M, Lamanna C, Marchionni N, Mannucci E. Rosiglitazone and risk of cancer: a meta-analysis of randomized clinical trials. Diabetes Care 31: 1455-1460, 2008.
30. Lewis JD, Ferrara A, Peng T, et al. Risk of bladder cancer among diabetic patients treated with pioglitazone: interim report of a longitudinal cohort study. Diabetes Care 34: 916-922, 2011.
31. Piccinni C, Motola D, Marchesini G, et al. Assessing the association of pioglitazone use and bladder cancer through drug adverse event reporting. Diabetes Care 34: 1369-1371, 2011.
32. Dormandy J, Bhattacharya M, van Troostenburg de Bruyn AR: Safety and tolerability of pioglitazone in high-risk patients with type 2 diabetes: an overview of data from PROactive. Drug Saf 32: 187-202, 2009.
33. Food and Drug Administration. FDA drug safety communication: ongoing safety review of actos (pioglitazone) and potential increased risk of bladder cancer after two years exposure [Internet], 2010. Silver Spring, MD, u.s. Food and Drug Administration. Available from http://www.fda.gov/Drugs/DrugSafety/ucm226214.htm. Accessed 21 October 2010.
34. Bone HG, Lindsay R, McClung MR, et al. Effects of pioglitazone on bone in postmenopausal women with impaired fasting glucose or impaired glucose tolerance: a randomized, double-blind, placebo-controlled study. J Clin Endocrinol Metab 98: 4691-701, 2013.
35. Benvenuti S, Cellai I, Luciani P, et al. Rosiglitazone stimulates adipogenesis and decreases osteoblastogenesis in human mesenchymal stem cells. J Endocrinol Invest30: RC26-30, 2007.
36. Loke YK, Singh S, Furberg CD. Long-term use of thiazolidinediones and fractures in type 2 diabetes: a meta-analysis. CMAJ 180: 32-39, 2009.
[/Protected]