Paolo Pozzilli
Università Campus Bio-Medico di Roma, Area di Endocrinologia e Diabetologia
Lettura in occasione del Premio Celso tenutasi a Bologna al 50° Congresso della Società Italiana di Diabetologia, 30 maggio 2014
Ringrazio la Società Italiana di Diabetologia per il conferimento del Premio Celso che onora non solo me, ma tutta la Scuola Diabetologica Romana che nel corso degli ultimi 30 anni ha condotto ricerche nell’ambito del diabete di tipo 1, con particolare riferimento alla patogenesi ed all’immunoterapia di questa forma di diabete, prima all’Università “Sapienza” e poi all’Università Campus Bio-Medico di Roma.
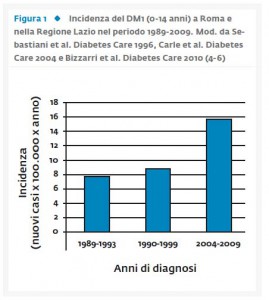
Nel corso dell’ultimo decennio le nostre conoscenze sulla patogenesi e la storia naturale del diabete di tipo 1 (DM1) sono cresciute notevolmente, in particolare per quanto riguarda epidemiologia, predizione, funzione β-cellulare e potenziali nuove forme di immunoterapia per salvaguardare le β-cellule ancora attive al momento della diagnosi (1). Sebbene il DM1 possa essere diagnosticato a tutte le età, è la patologia cronica più comune dell’infanzia e dell’adolescenza (2). I picchi d’incidenza di questa malattia sono tra i 5-7 anni, prima della pubertà o in prossimità della stessa (1, 3). Vari studi, condotti dal nostro gruppo sull’incidenza del DM1 in bambini e ragazzi sotto i 15 anni di età sia in Italia che nella regione Lazio e nella città di Roma (4-6), hanno evidenziato che l’incidenza di questa malattia è in continua crescita dai 7,9 casi x 100.000 x anno nel periodo 1989-1993 ai 15,7 casi x 100.000 x anno nel periodo 2004-2009 (<15 anni di età) (Fig. 1). I risultati riportano inoltre una più elevata incidenza della malattia nella fascia di età compresa tra i 5-9 anni (10,4 casi x 100.000) e nella stagione invernale (36,2%) (6). Tuttavia l’incremento di incidenza del DM1 al di sotto dei 15 anni di età riscontrato nella regione Lazio ricalca il pattern europeo delle ultime due decadi (7).
FAD ECM “IL DIABETE”
Questa rassegna fa parte di un percorso di formazione a distanza accreditato a livello nazionale e disponibile gratuitamente nell’aula virtuale della SID (http://www.fad.siditalia.it).
Per partecipare al corso occorre:
1. Leggere la rassegna (disponibile anche on-line)
2. registrarsi all’aula e iscriversi al corso “il Diabete”
3. rispondere on-line al quiz di verifica e compilare il questionario di valutazione dell’evento FAD.
Una volta eseguito con successo il test di valutazione e compilato il questionario di valutazione dell’evento, sarà cura della Segreteria ECM della SID far pervenire l’attestato ECM del corso ai diretti inte- ressati nei tempi e nelle modalità stabiliti dalla regolamentazione vigente.
Per ulteriori informazioni: http://www.fad.siditalia.it
> Scarica l’articolo in formato PDF
I MARCATORI GENETICI (HLA E ALTRI GENI) E LORO SIGNIFICATO NEL DM1
MESSAGGI CHIAVE
- I principali geni responsabili di almeno il 50% della componente genetica del DM1 risultano essere: i geni associati all’antigene leucocitario umano (HLA) localizzato nel cromosoma 6p21 (IDDM1); il gene localizzato nella regione codificante il gene dell’insulina sul cromosoma 11p15(IDDM2); i geni localizzati nell’area IDDM3 sul cromosoma 15q26, IDDM7 sul 2q21 e IDDM8 nel cromosoma 6q27; PTPN22 nel cromosoma 1p13 ed IL-2RA nel cromosoma 10p15.
- Il gene per il CTLA-4 nel cromosoma 2q33 rappresenta un forte candidato per le malattie autoimmuni mediate dai linfociti T poiché ha un ruolo significativo nel regolare negativamente l’attivazione dei linfociti T. Un’alterata espressione di CTLA-4 o della sua funzione possono predisporre all’autoimmunità organo- specifica nel DM1.
- Le distribuzioni genotipiche dell’HLA hanno rilevato negli ultimi decenni un trend di riduzione delle frequenze del genotipo DR3, DR4 che conferisce la maggiore suscettibilità al DM1 in Paesi con più alta incidenza della malattia, ma non in quelli con bassa o media incidenza quali l’Italia continentale.
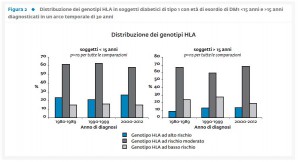
La combinazione di fattori genetici, ambientali ed immunologici è utile per la predizione del DM1 (8). Trattasi di una patologia complessa sostenuta da più geni di suscettibilità che interagiscono con fattori ambientali inducenti o scatenanti una risposta autoimmune verso le β-cellule. Alcuni fattori ambientali possono influenzare la velocità di progressione del danno β cellulare. Parte del rischio genetico stimabile può essere quantificato alla nascita o nel periodo neonatale a partire sia dalle informazioni inerenti la storia familiare per DM1 che dalla presenza di specifici alleli di geni che contribuiscono al rischio familiare (8). I principali geni, responsabili di almeno il 50% della componente genetica del DM1, risultano essere associati all’antigene leucocitario umano (HLA) localizzato nel cromosoma 6p21 (IDDM1) (9). Un altro gene coinvolto nel rischio genetico per il DM1 si trova nella regione codificante per l’insulina (INS-VNTR) sul cromosoma 11p15 (IDDM2) (10). Tuttavia, dal momento che il linkage tra IDDM1 e IDDM2 da solo non spiega il clustering del DM1 nelle famiglie, è stato ipotizzato il coinvolgimento di altri geni. Ulteriori analisi hanno poi confermato la presenza di altre regioni geniche coinvolte quali IDDM3 nel cromosoma 15q26, IDDM7 nel 2q21, IDDM8 nel 6q27, PTPN22 nel cromosoma 1p13 ed IL-2RA nel cromosoma 10p15 (11). Nel cromosoma 2q33, infine, c’è una regione che contiene i geni CTLA-4 e CD28 che si è ipotizzato possano avere un ruolo nella patogenesi delle malattie autoimmuni, incluso il DM1 (12-13). Il CTLA-4, in particolare, rappresenta un forte candidato per le malattie autoimmuni mediate dai linfociti T poiché ha un ruolo importante nel regolarne negativamente l’attivazione. In un nostro studio condotto da Nisticò et al. (12) è stato dimostrato un linkage disequilibrium tra DM1 e gene CTLA-4 valutato mediante analisi di linkage e di associazione in un vasto campione di famiglie di origine caucasica affette da DM1 ed in un ampio studio caso-controllo. È stato inoltre osservato che immunoglobuline rivolte verso il CTLA-4 sono in grado di inibire in una fase precoce lo sviluppo della malattia (14). Quindi, dal momento che la disregolazione dei linfociti T sembra caratterizzare il meccanismo di autoimmunità sia nel topo che nell’uomo in cui sono stati riportati difetti dell’apoptosi, questi risultati, considerati globalmente, suggeriscono che un’alterata espressione del CTLA-4 o della sua funzione possano predisporre all’autoimmunità organo-specifica incluso il DM1 (13-14). In un nostro studio condotto da Spoletini et al., sono state valutate le distribuzioni genotipiche dell’HLA nella popolazione dell’Italia continentale (9). I soggetti presi in esame, caucasici con genitori di origini italiane, e con età alla diagnosi di DM1 compresa tra 1 e 49 anni (12,7±8,9), sono stati suddivisi in 2 sottogruppi, <15 anni e >15 anni di età al momento dell’esordio della malattia. Per la valutazione dell’andamento temporale, tutti i soggetti sono stati raggruppati per decadi di diagnosi: 1980-1989; 1990-1999; 2000-2012. I genotipi HLA sono stati classificati in tre categorie di rischio (alto, medio e basso), sulla base di valori di rischio assoluto, precedentemente stimati nella popolazione italiana continentale (regione Lazio) (15). La distribuzione dei genotipi HLA in soggetti con età di esordio <15 anni e >15 anni secondo i tre gruppi di decadi è riportata nella figura 2.
I risultati ottenuti hanno mostrato che la proporzione delle tre categorie di rischio genotipico HLA non era statisticamente differente tra le coorti di soggetti con età <15 anni e >15anni. Da questi risultati non è dunque emerso alcun cambiamento temporale significativo nelle distribuzioni genotipiche dell’HLA di classe II nelle ultime decadi sia in bambini <15 anni con DM1 che in soggetti adulti. L’evidenza riscontrata nello studio di Spoletini et al. è in linea con i risultati riportati anche da un recente studio condotto in un vasto campione di soggetti di provenienza austriaco-tedesca con DM1 con esordio della malattia ≥20 anni (16).
LA SUSCETTIBILITA’ GENETICA ED I FATTORI AMBIENTALI NELLA PREDIZIONE DEL DM1
MESSAGGI CHIAVE
- I fattori ambientali possono modificare la penetranza della suscettibilità dei geni HLA, oppure, in qualità di fattori scatenanti, possono contribuire direttamente a determinare l’insorgenza della patologia. L’esposizione ad antigeni alimentari e a batteri in età molto precoce o addirittura in utero potrebbe di fatto essere implicata nell’ aumento di incidenza del DM1.
- L’esposizione al latte vaccino in età precoce può rappresentare l’agente favorente una risposta anti β-caseina cross-reagente per mimetismo molecolare nei confronti di un antigene β-cellulare in soggetti geneticamente predisposti. Integrando nei primi mesi di vita l’allattamento al seno con latte in polvere altamente idrolisato senza β-caseina, l’obiettivo dello studio TRIGR è stato quello di bloccare la risposta autoimmune nei confronti delle β-cellule attraverso la non esposizione alla β-caseina del latte vaccino.
- Il Network Bayesiano (BN) è un modello grafico che consente di effettuare una stratificazione del rischio di DM1 determinando in una popolazione in studio il rischio combinato di sviluppare la malattia considerando simultaneamente i diversi markers genetici di suscettibilità.
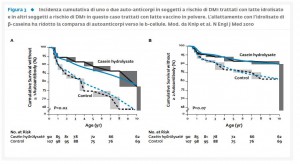
Dal momento che i genotipi di suscettibilità al DM1 non sono cambiati nel corso degli ultimi 30 anni in Italia, ne scaturisce che, verosimilmente, i fattori ambientali abbiano avuto un peso maggiore sulla patogenesi e possano aver svolto un ruolo determinante nella progressione del DM1 spiegandone così la crescente incidenza nei paesi sviluppati (9). L’aumentata incidenza del DM1 nei bambini suggerisce che questi siano esposti a fattori ambientali in età molto precoce o addirittura nell’utero (17). Nei soggetti geneticamente suscettibili, infatti, sembra che l’esposizione a fattori ambientali durante il periodo gestazionale e nel primo anno di vita possa innescare il processo autoimmune che porta, in ultimo, alla distruzione β-cellulare ed alla comparsa del DM1. In un nostro precedente studio condotto da Visalli et al. (18) in cui sono stati presi in esame 150 soggetti con DM1 e 750 controlli residenti nella città di Roma e nella Provincia, si è riscontrata nei diabetici una maggior presenza di tre fattori di rischio tra cui le malattie infettive nella madre durante il periodo gestazionale; la presenza di eczema nei primi mesi di vita e una breve durata dell’allattamento al seno (<3 mesi). I risultati inerenti le abitudini di svezzamento evidenziano che, come in altri Paesi europei, anche nella regione Lazio un periodo di allattamento al seno <3 mesi costituisce un fattore di rischio per lo sviluppo di DM1. In altri studi (19-20), inoltre, è stato valutato l’effetto del latte vaccino quale agente scatenante una risposta autoimmune da parte della β-cellula in soggetti geneticamente predisposti ed in soggetti con DM1 conclamato. Nel primo caso Knip et al. (19) hanno effettuato un trial clinico (Studio TRIGR) in 230 neonati con suscettibilità al DM1 HLA-confermata per testare l’ipotesi che integrando per i primi 6-8 mesi l’allattamento al seno con latte in polvere altamente idrolisato si potesse diminuire l’incidenza cumulativa di autoanticorpi anti β-cellule associati al DM1. Il periodo di osservazione dei livelli anticorpali è stato di 10 anni. Lo studio ha confermato l’ipotesi dimostrando che il trattamento con latte altamente idrolisato si associava in bambini fino ai 10 anni di età ad una riduzione nello sviluppo di autonticorpi verso le β-cellule rispetto al gruppo di controllo trattato invece con latte vaccino in polvere (Fig. 3).
In un altro lavoro del nostro gruppo Cavallo et al. (20), hanno testato l’ipotesi che anche l’immunità cellulo-mediata potesse essere coinvolta attraverso il riconoscimento della β-caseina come antigene nell’indurre il danno β-cellulare. Sono stati studiati i linfociti T di 47 soggetti con DM1, 36 soggetti sani e 10 soggetti con patologia tiroidea autoimmune impiegati come gruppo di controllo. In tutti i soggetti presi in esame è stata effettuata la misurazione in vitro della risposta proliferativa dei linfociti T alla β-caseina. I risultati hanno mostrato che nei soggetti con DM1 si evidenziava una specifica proliferazione dei linfociti T con una significativa differenza sia verso i soggetti di controllo (p<0,00001) che in pazienti con patologia tiroidea autoimmune (p<0,002) (Fig. 4). 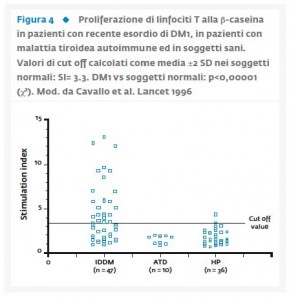 Questi dati hanno confermato l’ipotesi che la β-caseina del latte vaccino possa fungere da antigene nel DM1 attraverso un meccanismo di mimetismo molecolare con il trasportatore del glucosio (GLUT-2) noto autoantigene β-cellulare nel DM1 (21-23). Pertanto sia l’allattamento al seno che il ritardo dell’esposizione al latte vaccino (oppure la sostituzione con un latte altamente idrolisato) potrebbero risultare uno strumento preventivo nello sviluppo del DM1 in quanto non si verrebbe a generare l’autoimmunità precoce verso le β-cellule (18-19). Poiché lo sviluppo del DM1 sembra essere quindi il risultato dell’interazione geni-ambiente, in che modo è possibile combinare i markers genetici con i fattori ambientali predisponenti per un calcolo accurato del rischio di malattia? Fino ad ora sono stati sempre condotti studi di linkage o di associazione, tuttavia in un nostro recente studio di Portuesi et al. (24) è stato proposto l’impiego del Network Bayesiano (BN) per determinare in una popolazione caucasica il rischio combinato di sviluppare il DM1 considerando simultaneamente differenti markers genetici (HLA-DRB1, INS-VNTR, PTPN22) coinvolti nel determinare la malattia. Il Network Bayesiano è un modello grafico che codifica relazioni probabilistiche tra variabili d’interesse. Tale caratteristica può rivelarsi fondamentale nello studio di malattie multifattoriali ove gli elementi scatenanti i complessi meccanismi di fisiopatologia del DM1 appaiono molteplici (25-27). Pertanto l’impiego del network bayesiano per effettuare una stratificazione del rischio potrebbe rivelarsi molto utile al fine di attuare strategie di tipo preventivo (24).
Questi dati hanno confermato l’ipotesi che la β-caseina del latte vaccino possa fungere da antigene nel DM1 attraverso un meccanismo di mimetismo molecolare con il trasportatore del glucosio (GLUT-2) noto autoantigene β-cellulare nel DM1 (21-23). Pertanto sia l’allattamento al seno che il ritardo dell’esposizione al latte vaccino (oppure la sostituzione con un latte altamente idrolisato) potrebbero risultare uno strumento preventivo nello sviluppo del DM1 in quanto non si verrebbe a generare l’autoimmunità precoce verso le β-cellule (18-19). Poiché lo sviluppo del DM1 sembra essere quindi il risultato dell’interazione geni-ambiente, in che modo è possibile combinare i markers genetici con i fattori ambientali predisponenti per un calcolo accurato del rischio di malattia? Fino ad ora sono stati sempre condotti studi di linkage o di associazione, tuttavia in un nostro recente studio di Portuesi et al. (24) è stato proposto l’impiego del Network Bayesiano (BN) per determinare in una popolazione caucasica il rischio combinato di sviluppare il DM1 considerando simultaneamente differenti markers genetici (HLA-DRB1, INS-VNTR, PTPN22) coinvolti nel determinare la malattia. Il Network Bayesiano è un modello grafico che codifica relazioni probabilistiche tra variabili d’interesse. Tale caratteristica può rivelarsi fondamentale nello studio di malattie multifattoriali ove gli elementi scatenanti i complessi meccanismi di fisiopatologia del DM1 appaiono molteplici (25-27). Pertanto l’impiego del network bayesiano per effettuare una stratificazione del rischio potrebbe rivelarsi molto utile al fine di attuare strategie di tipo preventivo (24).
I MARCATORI IMMUNOLOGICI E LA LORO APPLICAZIONE CLINICA NEL DM1
MESSAGGI CHIAVE
- I marcatori immunologici consentono di monitorare la progressione della malattia dalla fase preclinica fino alla diagnosi conclamata di DM1.
- Nelle malattie autoimmuni organo-specifiche l’infiltrato di cellule mononucleate nei tessuti target, segno distintivo di patologia in atto, può verificarsi nella fase pre-clinica ed essere valutato in modo non invasivo mediante l’ausilio di una scintigrafia che impiega interleuchina 2 (IL-2) marcata con il tecnezio o con lo iodio 123 (I123).
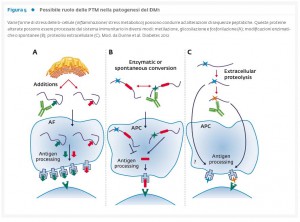
- Il cross-talk funzionale tra le β-cellule pancreatiche ed il sistema immunitario è un evento chiave nella patogenesi del DM1, in particolare per la presenza di autoantigeni espressi sulle β-cellule. Le modificazioni post-traduzionali (PTM) di proteine espresse a livello β-cellulare possono spiegare la perdita della tolleranza immunitaria e contribuire allo sviluppo di una risposta autoimmune specifica.
Se da un lato il DM1 in fase preclinica viene diagnosticato mediante l’ausilio di markers di tipo predittivo (genetico-immunologico), dall’altro la presenza di una risposta autoimmune con più di un autoanticorpo e la presenza dei linfociti T determinano la progressione della malattia dalla fase preclinica fino al danno esteso delle β-cellule. La valutazione dei markers genetici e lo studio dei fattori ambientali di suscettibilità in combinazione con i marcatori immunologici di progressione dell’autoimmunità β-cellulare porta quindi alla definizione di un modello globale di patogenesi del DM1 (8). Nelle malattie autoimmuni organo-specifiche l’infiltrato dovuto a cellule mononucleate nei tessuti target è un segno distintivo di patologia in atto e può verificarsi nella fase pre-clinica. La diagnosi di patologia autoimmune a questo stadio avrebbe una grande utilità di tipo clinico poiché consentirebbe di individuare soggetti altamente suscettibili di progressione verso il DM1 e di monitorare l’efficacia di un approccio terapeutico laddove intrapreso in una fase molto precoce. In un nostro lavoro condotto da Signore et al. (28) è stata proposta una tecnica di imaging per valutare l’infiltrato linfocitario nel pancreas endocrino in modo non invasivo. Tale metodica si basa su una scintigrafia che impiega IL-2 marcata con I123 o con tecnezio che lega i linfociti infiltranti con positività per i recettori per IL-2. Tale tecnica è stata utilizzata con successo in pazienti affetti da condizioni autoimmuni organo-specifiche quali DM1, tiroidite di Hashimoto e celiachia. Pertanto il suo impiego, oltre a fornire una dimostrazione del marker istopatologico nelle β-cellule localizzando l’infiltrato infiammatorio, può consentire di evidenziare il processo immunologico in vivo e non più solamente mediante markers sierologici.
In aggiunta alla presenza dell’infiltrato linfomonocitario, va sottolineato il cross-talk tra β-cellule ed autoanticorpi rivolti verso antigeni β-cellulari caratterizzanti più del 90% dei casi di DM1 all’esordio clinico. Di recente numerosi studi hanno evidenziato come le modificazioni post-traduzionali (PTM) delle proteine possano spiegare la perdita della tolleranza immunitaria e contribuire allo sviluppo di una risposta autoimmune (29-31) (Fig. 5). Le PTM possono essere di varia tipologia e sono state associate a malattie autoimmuni quali la celiachia (32), l’artrite reumatoide (33-35), il lupus eritematoso sistemico (36-38) e la sclerosi multipla (39).
Tra le numerose evidenze, recenti risultati di un nostro studio condotto da Strollo R. et al. hanno portato alla luce un probabile ruolo dello stress ossidativo nell’induzione di autoanticorpi rivolti verso il collagene di tipo II modificato post-traduzionalmente nell’artrite reumatoide (40). Abbiamo inoltre dimostrato che anche pazienti con DM1 presentano livelli di autoanticorpi verso il collagene di tipo II modificato dalle specie reattive dell’ossigeno e che questa risposta viene regolata dall’HLA, in particolare in soggetti portatori di HLA DRB1-04 noto allele di suscettibilità al SM1 e all’artrite reumatoide.
Il settore delle modifiche post-traduzionali delle proteine rappresenta un’area di grande interesse nello sviluppo delle patologie autoimmuni e potrebbe aprire un nuovo scenario sia nella prevenzione che nel trattamento di tali patologie, ad esempio l’immunoterapia antigene-specifica per sopprimere o modificare il decorso di una malattia.
IL MANTENIMENTO DELLA FUNZIONE B-CELLULARE (C-PEPTIDE)
MESSAGGI CHIAVE
- Il C-peptide nel plasma rappresenta il marker diretto della riserva funzionale β-cellulare.
- Vi è una correlazione positiva tra età alla diagnosi di DM1 e C-peptide basale con valori più bassi della funzione β-cellulare in pazienti con insorgenza di malattia in età più precoce.
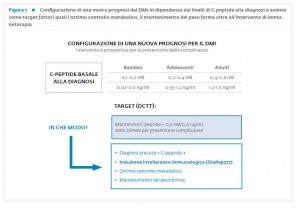
 Il DM1 sul piano clinico è una malattia che appare quando una parte sostanziale della funzione β-cellulare è venuta meno. Attualmente, il trattamento di questa malattia è basato sull’impiego di insulina e non sono purtroppo disponibili trattamenti curativi. Il C-peptide misurato in condizioni standardizzate con alta riproducibilità rappresenta il marker diretto della riserva funzionale β-cellulare, tuttavia, sia alla diagnosi che negli anni successivi la riserva funzionale β-cellulare varia notevolmente tra soggetto e soggetto e dipende da vari fattori quali l’età d’insorgenza del DM1, l’HLA, il peso e lo scompenso metabolico.
Il DM1 sul piano clinico è una malattia che appare quando una parte sostanziale della funzione β-cellulare è venuta meno. Attualmente, il trattamento di questa malattia è basato sull’impiego di insulina e non sono purtroppo disponibili trattamenti curativi. Il C-peptide misurato in condizioni standardizzate con alta riproducibilità rappresenta il marker diretto della riserva funzionale β-cellulare, tuttavia, sia alla diagnosi che negli anni successivi la riserva funzionale β-cellulare varia notevolmente tra soggetto e soggetto e dipende da vari fattori quali l’età d’insorgenza del DM1, l’HLA, il peso e lo scompenso metabolico.
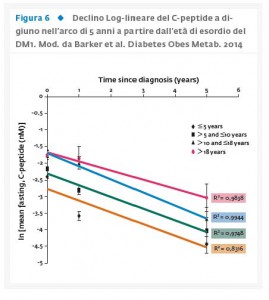
Per valutare il declino del C-peptide nel corso della malattia il nostro gruppo ha coordinato uno studio multicentrico in∼ 4000 pazienti affetti da DM1. I pazienti sono stati suddivisi in 4 gruppi in base all’età di esordio della malattia (<5 anni, 5-10 anni, 10-18 anni, >18 anni) e nei quali è stato valutato il C-peptide basale alla diagnosi, ad un anno e a 5 anni di follow-up. Lo studio ha dimostrato una correlazione positiva tra età alla diagnosi di DM1 e C-peptide basale con valori più bassi della funzione β-cellulare registrati nei pazienti con insorgenza di malattia in età più precoce (41) (Fig. 6). Analogamente un nostro studio condotto dal gruppo IMDIAB aveva precedentemente dimostrato che il processo distruttivo delle β-cellule nei soggetti giovani adulti è meno aggressivo rispetto ai bambini con valori più elevati di C-peptide che persistono per molti anni dopo la diagnosi (42).
LA NUOVA PROGNOSI DEL DM1 CON L’IMMUNOTERAPIA ED ALTRE STRATEGIE DI INTERVENTO ALLA DIAGNOSI
MESSAGGI CHIAVE
- La funzione β-cellulare residua, valutata attraverso i livelli di C-peptide basale e/o stimolato in pazienti affetti da DM1 di recente insorgenza, è indice di efficacia nei trial clinici di immunointervento implementati a partire dalla diagnosi.
- I risultati dello studio DIA-AID nel DM1 hanno dimostrato che il trattamento con DiaPep277 è sicuro e ben tollerato e che questo peptide è in grado di conservare in modo significativo i livelli di C-peptide nei pazienti trattati rispetto al gruppo trattato con placebo.
- In un futuro prossimo sono dunque auspicabili in pazienti con DM1 ed adeguata riserva β-cellulare nuovi scenari terapeutici: una somministrazione quotidiana d’insulina basale, una somministrazione settimanale di un analogo del GLP1 a lento rilascio con l’aggiunta di una somministrazione trimestrale di un peptide in grado di preservare i livelli di C-peptide (DiaPep277).
L’immunointervento alla diagnosi di DM1 mira a prevenire o “bloccare” la malattia preservando e/o ripristinando la massa β-cellulare residua e può attuarsi attraverso la somministrazione di farmaci in grado di controllare la risposta autoimmune verso la β-cellula. Recenti trials clinici di immunointervento in pazienti affetti da DM1 di recente insorgenza hanno dimostrato come sia possibile controllare l’autoimmunità preservando la secrezione insulinica endogena. La funzione β-cellulare residua, valutata attraverso i livelli di C-peptide basale e/o stimolato in pazienti affetti da DM1 neodiagnosticato, è comunemente utilizzata come indice di efficacia nei trial clinici di immunointervento (Fig. 7).
Solo di recente si è convenuto che un immunointervento dovesse esser condotto solo sui soggetti con sostanziale residua funzione β cellulare. In passato venivano inclusi nei trials pazienti con DM1 di recente insorgenza senza considerare i livelli di C-peptide. Ciò può spiegare il fallimento di numerosi interventi di immunoterapia e lo scetticismo di molti nella considerazione di questa forma di intervento. Come già detto è importante tenere in considerazione che i livelli di C-peptide basale e/o stimolato possono essere molto diversi al momento della diagnosi di malattia, essendo più alti negli adulti ed in soggetti giovani in età puberale rispetto ai soggetti pre-puberi. Anche il fattore età deve essere quindi preso in considerazione nel disegnare trials clinici volti alla prevenzione della distruzione delle β-cellule. Grande interesse hanno suscitato negli ultimi anni diverse sperimentazioni cliniche multicentriche in soggetti affetti da DM1 di recente diagnosi. Tali studi si sono posti l’obiettivo di preservare la funzione β-cellulare residua attraverso l’induzione della tolleranza immunologica. 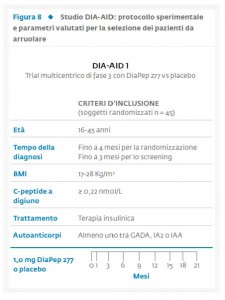 Di particolare interesse sono risultati i dati emersi dallo studio DIA-AID 1 da noi recentemente pubblicati su Diabetes Care (43). DiaPep277, il maggiore epitopo della heat shock protein 60 (hsp60), è composto da 24 amminoacidi (posizione 437-460) che derivano dalla porzione C-terminale della hsp60. Questo peptide è stato modificato per aumentare la sua stabilità in vivo, andando a sostituire due cisteine in posizione 6 e 11 con due valine, senza però alterare le proprietà immunologiche della sequenza originale p277. A seguito dei risultati incoraggianti emersi nel corso di precedenti studi di fase II (44-45) è stato disegnato lo studio DIA-AID 1, trial multicentrico, di fase 3, randomizzato, condotto in doppio cieco (DiaPep 277 vs placebo). Un totale di 457 pazienti affetti da DM1, di età compresa tra 16-45 anni, è stato randomizzato a somministrazioni sottocutanee di DiaPep277 o placebo per 2 anni a cadenza trimestrale. L’end point primario dello studio era rappresentato dalle variazioni del C-peptide attraverso la misurazione dell’area sotto la curva (AUC) dopo stimolo con 1 mg di glucagone (Fig. 8). I risultati di questo studio hanno dimostrato che DiaPep 277 è in grado di conservare in maniera significativa i livelli di C-peptide nei pazienti trattati rispetti rispetto al gruppo di controllo (43). Inoltre un maggior numero di pazienti trattati con DiaPep 277 manteneva livelli di HbA1c <7% a due anni dall’inizio del trattamento e mostrava un numero ridotto di eventi ipoglicemici confermando così che il trattamento con DiaPep277 era sicuro e ben tollerato nonché in grado di migliorare il controllo metabolico. In aggiunta, essendo il mantenimento della funzione β-cellulare dipendente da diversi fattori, è necessario che oltre all’induzione della tolleranza immunologica sia anche garantita la riduzione della glucotossicità avvalendosi delle nuove tecnologie disponibili (microinfusore d’insulina) con il raggiungimento di un controllo glicemico ottimale fin dalle fasi più precoci della malattia come dimostrato in un recente trial clinico condotto in Germania (46). In questo scenario si può ipotizzare l’impiego anche di nuovi farmaci quali gli analoghi del GLP1 che agiscono favorendo la secrezione insulinica, la rigenerazione β-cellulare ed una maggiore sensibilità all’insulina (47-48). Studi in vitro e su modelli animali di diabete immuno-mediato hanno dimostrato che questa classe di farmaci è in grado di espandere la massa β-cellulare attraverso meccanismi volti ad aumentare l’espressione di fattori di trascrizione chiave come homebox1 pancreatico e duodenale, la stimolazione della neogenesi delle isole pancreatiche, la proliferazione β-cellulare, la differenziazione dei precursori putativi delle β-cellule e l’inibizione dell’apoptosi delle β-cellule (49). Gli effetti degli analoghi del GLP1, sono stati valutati anche nel topo NOD, modello animale del DM1. A tal proposito alcuni studi hanno dimostrato che exendin-4 è in grado di esercitare un effetto benefico sulla massa β-cellulare sia quando somministrato in combinazione con anticorpi anti-CD3 (50) sia impiegato come unico trattamento (51). Infine i risultati emersi da studi condotti i pazienti con DM1 ne sostengono l’utilizzo poiché gli agonisti del GLP1 sembrerebbero essere in grado di migliorare la funzione di isole pancreatiche trapiantate (52). Analogamente nei pazienti affetti da DM2 in trattamento con metformina che ricevono anche una terapia con agonisti del GLP1 si è osservata una funzione β-cellulare 2,4 volte superiore rispetto ai pazienti trattati con sola insulina (53). Anche se ad oggi i dati a sostegno dell’impiego delle incretine nei pazienti con DM 1 sono ancora limitati è comunque ipotizzabile alla luce di quanto affermato in precedenza che questa classe di farmaci possa favorire il mantenimento della funzione β-cellulare. Ad esempio in uno studio pilota condotto su 14 pazienti affetti da DM1 trattati per 6 mesi con exenatide è stato dimostrato che dosi elevate di questo analogo del GLP1 sono in grado di ridurre significativamente la glicemia post prandiale aumentando la sensibilità insulinica (54).
Di particolare interesse sono risultati i dati emersi dallo studio DIA-AID 1 da noi recentemente pubblicati su Diabetes Care (43). DiaPep277, il maggiore epitopo della heat shock protein 60 (hsp60), è composto da 24 amminoacidi (posizione 437-460) che derivano dalla porzione C-terminale della hsp60. Questo peptide è stato modificato per aumentare la sua stabilità in vivo, andando a sostituire due cisteine in posizione 6 e 11 con due valine, senza però alterare le proprietà immunologiche della sequenza originale p277. A seguito dei risultati incoraggianti emersi nel corso di precedenti studi di fase II (44-45) è stato disegnato lo studio DIA-AID 1, trial multicentrico, di fase 3, randomizzato, condotto in doppio cieco (DiaPep 277 vs placebo). Un totale di 457 pazienti affetti da DM1, di età compresa tra 16-45 anni, è stato randomizzato a somministrazioni sottocutanee di DiaPep277 o placebo per 2 anni a cadenza trimestrale. L’end point primario dello studio era rappresentato dalle variazioni del C-peptide attraverso la misurazione dell’area sotto la curva (AUC) dopo stimolo con 1 mg di glucagone (Fig. 8). I risultati di questo studio hanno dimostrato che DiaPep 277 è in grado di conservare in maniera significativa i livelli di C-peptide nei pazienti trattati rispetti rispetto al gruppo di controllo (43). Inoltre un maggior numero di pazienti trattati con DiaPep 277 manteneva livelli di HbA1c <7% a due anni dall’inizio del trattamento e mostrava un numero ridotto di eventi ipoglicemici confermando così che il trattamento con DiaPep277 era sicuro e ben tollerato nonché in grado di migliorare il controllo metabolico. In aggiunta, essendo il mantenimento della funzione β-cellulare dipendente da diversi fattori, è necessario che oltre all’induzione della tolleranza immunologica sia anche garantita la riduzione della glucotossicità avvalendosi delle nuove tecnologie disponibili (microinfusore d’insulina) con il raggiungimento di un controllo glicemico ottimale fin dalle fasi più precoci della malattia come dimostrato in un recente trial clinico condotto in Germania (46). In questo scenario si può ipotizzare l’impiego anche di nuovi farmaci quali gli analoghi del GLP1 che agiscono favorendo la secrezione insulinica, la rigenerazione β-cellulare ed una maggiore sensibilità all’insulina (47-48). Studi in vitro e su modelli animali di diabete immuno-mediato hanno dimostrato che questa classe di farmaci è in grado di espandere la massa β-cellulare attraverso meccanismi volti ad aumentare l’espressione di fattori di trascrizione chiave come homebox1 pancreatico e duodenale, la stimolazione della neogenesi delle isole pancreatiche, la proliferazione β-cellulare, la differenziazione dei precursori putativi delle β-cellule e l’inibizione dell’apoptosi delle β-cellule (49). Gli effetti degli analoghi del GLP1, sono stati valutati anche nel topo NOD, modello animale del DM1. A tal proposito alcuni studi hanno dimostrato che exendin-4 è in grado di esercitare un effetto benefico sulla massa β-cellulare sia quando somministrato in combinazione con anticorpi anti-CD3 (50) sia impiegato come unico trattamento (51). Infine i risultati emersi da studi condotti i pazienti con DM1 ne sostengono l’utilizzo poiché gli agonisti del GLP1 sembrerebbero essere in grado di migliorare la funzione di isole pancreatiche trapiantate (52). Analogamente nei pazienti affetti da DM2 in trattamento con metformina che ricevono anche una terapia con agonisti del GLP1 si è osservata una funzione β-cellulare 2,4 volte superiore rispetto ai pazienti trattati con sola insulina (53). Anche se ad oggi i dati a sostegno dell’impiego delle incretine nei pazienti con DM 1 sono ancora limitati è comunque ipotizzabile alla luce di quanto affermato in precedenza che questa classe di farmaci possa favorire il mantenimento della funzione β-cellulare. Ad esempio in uno studio pilota condotto su 14 pazienti affetti da DM1 trattati per 6 mesi con exenatide è stato dimostrato che dosi elevate di questo analogo del GLP1 sono in grado di ridurre significativamente la glicemia post prandiale aumentando la sensibilità insulinica (54). Analogamente un altro studio ha mostrato l’efficacia di Liragutide nel ridurre il fabbisogno insulinico in pazienti affetti da DM 1 con livelli di C-peptide ≥0,06nmol/L (55). Sono numerosi attualmente i trials in corso utilizzando le incretine nel DM1 ed anche nel LADA a testimonianza dell’interesse di impiego di questi farmaci nel controllare sia la glicemia post-prandiale che nel favorire la rigenerazione β cellulare. Ciò è di certo attuabile laddove la secrezione residua di β cellule è preservata. Infine non dobbiamo dimenticare che uno dei problemi ancora difficile da risolvere riguarda la compliance alla terapia nel paziente affetto da DM1. È noto che 1 su 3 pazienti non aderisce alle indicazioni terapeutiche. Dobbiamo riuscire a motivare il paziente impiegando informazioni dettagliate offerte con stile semplice ma fortemente comunicativo, con l’obiettivo di ridurre i disturbi dell’umore e la depressione che spesso affliggono questi pazienti. L’educazione a saper gestire il DM1 fin dai primi mesi di malattia rappresenta un target irrinunciabile nel management di questa condizione morbosa. In conclusione, in un futuro prossimo è auspicabile in pazienti con DM1 ed adeguata riserva β-cellulare un nuovo scenario terapeutico includente una somministrazione quotidiana d’insulina basale, una somministrazione settimanale di un analogo di GLP1 a lento rilascio e la somministrazione trimestrale di un peptide (DiaPep 277) in grado di conservare i livelli di C-peptide, se gli studi fin qui condotti saranno confermati (Fig. 9).
Analogamente un altro studio ha mostrato l’efficacia di Liragutide nel ridurre il fabbisogno insulinico in pazienti affetti da DM 1 con livelli di C-peptide ≥0,06nmol/L (55). Sono numerosi attualmente i trials in corso utilizzando le incretine nel DM1 ed anche nel LADA a testimonianza dell’interesse di impiego di questi farmaci nel controllare sia la glicemia post-prandiale che nel favorire la rigenerazione β cellulare. Ciò è di certo attuabile laddove la secrezione residua di β cellule è preservata. Infine non dobbiamo dimenticare che uno dei problemi ancora difficile da risolvere riguarda la compliance alla terapia nel paziente affetto da DM1. È noto che 1 su 3 pazienti non aderisce alle indicazioni terapeutiche. Dobbiamo riuscire a motivare il paziente impiegando informazioni dettagliate offerte con stile semplice ma fortemente comunicativo, con l’obiettivo di ridurre i disturbi dell’umore e la depressione che spesso affliggono questi pazienti. L’educazione a saper gestire il DM1 fin dai primi mesi di malattia rappresenta un target irrinunciabile nel management di questa condizione morbosa. In conclusione, in un futuro prossimo è auspicabile in pazienti con DM1 ed adeguata riserva β-cellulare un nuovo scenario terapeutico includente una somministrazione quotidiana d’insulina basale, una somministrazione settimanale di un analogo di GLP1 a lento rilascio e la somministrazione trimestrale di un peptide (DiaPep 277) in grado di conservare i livelli di C-peptide, se gli studi fin qui condotti saranno confermati (Fig. 9).
Ringraziamenti
Ringrazio le Dott.sse Sara Fallucca, Chiara Guglielmi, Annarita Maurizi e Valentina Greto per il loro importante contributo alla stesura di questa rassegna. Ringrazio tutta l’Area di Endocrinologia e Diabetologia dell’Università Campus Bio-Medico di Roma ed i collaboratori sia in Italia che all’estero per il lavoro svolto insieme in tutti questi anni. Ringrazio infine la mia famiglia ed in particolar modo mia moglie, la Prof.ssa Raffaella Buzzetti, compagna di vita e di lavoro in tutti questi anni di intensa e gratificante attività di ricerca sul diabete.
Bibliografia
1. Atkinson MA, Eisenbarth GS, Michels AW. Type 1 diabetes. Lancet 383: 69-82, 2014.
2. Patterson CC, Dahlquist GG, Gyürüs E. et al. EURODIAB Study Group. Incidence trends for childhood type 1 diabetes in Europe during 1989-2003 and predicted new cases 2005-20: a multicentre prospective registration study. Lancet. Jun 13; 373(9680): 2027-2033, 2009.
3. Harjutsalo V, Sjoberg L, Tuomilehto J. Time trends in the incidence of type 1 diabetes in Finnish children: a cohort study. Lancet 371: 1777-1782, 2008.
4. Sebastiani L, Visalli N, Adorisio E et al. A 5-year (1989-1993) prospective study of the incidence of IDDM in Rome and the Lazio region in the age-group 0-14 years. Diabetes Care. Jan; 19(1): 70-73, 1996.
5. Carle F, Gesuita R, Bruno G et al. Diabetes incidence in 0- to 14-year age-group in Italy: a 10-year prospective study. Diabetes Care. Dec; 27(12): 2790-2796, 2004.
5. Bizzarri C, Patera PI, Arnaldi C et al. Incidence of type 1 diabetes has doubled in Rome and the Lazio region in the 0- to 14-year age-group: a 6-year prospective study (2004-2009). Diabetes Care. Nov; 33(11):e140, 2010.
6. Patterson CC, Gyürüs E, Rosenbauer J et al. Trends in childhood type 1 diabetes incidence in Europe during 1989-2008: evidence of non-uniformity over time in rates of increase. Diabetologia. Aug; 55(8): 2142-2147, 2012.
7. Ziegler AG, Nepom GT. Prediction and Pathogenesis in Type 1 Diabetes. Immunity. Apr 23; 32(4): 468-478, 2010.
8. Spoletini ML, Zampetti S, Campagna G. et al. Temporal Trends of HLA, CTLA-4 and PTPN22 Genotype Frequencies among Type 1 Diabetes in Continental Italy. PLoSOne. Apr 17; 8(4):e61331, 2013.
9. Marchand L, Polychronakos C. Evaluation of polymorphic splicing in the mechanism of the association of the insulin gene with diabetes. Diabetes. Mar; 56(3): 709-713, 2007.
10. Howson JMM, Rosinger S, Smyth DJ et al. Genetic Analysis of Adult-Onset Autoimmune Diabetes. Diabetes 60: 2645-2653, 2011.
11. Nisticò L, Buzzetti R, Pritchard LE et al. The CTLA-4 gene region of chromosome 2q33 is linked to, and associated with, type 1 diabetes. Human Molecular Genetics. Vol. 5, No. 7 1075-1080, 1996.
12. Pozzilli P, Buzzetti R, Nisticò L et al. Non-HLA genes and the susceptibility to insulin dependent diabetes: the role of the CTLA-4 gene. Acta Diabetol 33: 250-252, 1996.
13. Wang J, Liu L, Ma J. et al. Common variants on cytotoxic T lymphocyte antigen-4 polymorphisms contributes to type 1 diabetes susceptibility: evidence based on 58 studies. PLoSOne. Jan 23; 9(1): e85982, 2014.
14. Buzzetti R, Galgani A, Petrone A et al. Genetic prediction of type 1 diabetes in a population with low frequency of HLA risk genotypes and low incidence of the disease (the DIABFIN study). Diabetes Metab Res Rev 20: 137-143, 2004.
15. Awa WL, Boehm BO, Kapellen T et al. HLA-DR genotypes influence age at disease onset in children and juveniles with type 1diabetes mellitus. Eur J Endocrinol 163: 97-104, 2010.
16. Stene LC, Gale EA. The prenatal environment and type 1 diabetes. Diabetologia. Sep; 56(9): 1888-1897, 2013.
18. Visalli N, Sebastiani L, Adorisio E et al. Environmental risk factors for type 1 diabetes in Rome and province. Arch Dis Child 88: 695-698, 2003.
19. Knip M, Virtanen SM, Seppä K et al. Dietary Intervention in Infancy and Later Signs of Beta-Cell Autoimmunity. N Engl J Med 363: 1900-1908, 2010.
20. Cavallo MG, Fava D, Monetini L et al. Cell-mediated immune response to β-casein in recent-onset insulin-dependent diabetes: implications for disease pathogenesis. Lancet 348: 926-928, 1996.
21. Johnson JH, Crider BP, McCorkle K et al. Inhibition of glucose transport into rat islet cells by immunoglobulins from patients with new-onset insulin-dependent diabetes mellitus. N Engl J Med. Mar 8; 322(10): 653-659, 1990.
22. Inman LR, McAllister CT, Chen L et al. Autoantibodies to the GLUT-2 glucose transporter of beta cells in insulin-dependent diabetes mellitus of recent onset. ProcNatlAcad Sci USA. Feb 15; 90(4): 1281-1284, 1993.
23. Bhattacharya P, Fan J, Haddad C et al. A novel pancreatic β-cell targeting bispecific-antibody (BsAb) can prevent the development of Type 1 diabetes in NOD mice. Clin Immunol. Jul; 153(1): 187-198, 2014.
24. Portuesi R, Pozzilli P, Boehm B et al. Assessment of Type 1 Diabetes Risk Conferred by HLADRB1, INS-VNTR and PTPN22 Genes Using the Bayesian Network Approach. PLoS One. Nov 18; 8(11): e79506, 2013.
25. Thomas D, Langholz B, Clayton D et al. Empirical Bayes Methods for Testing Associations with Large Numbers of Candidate Genes in the Presence of Environmental Risk Factors, with Applications to HLA Associations in IDDM. Annals of Medicine 24: 387-392, 1992.
26. Scharpf RB, Tjelmeland H, Parmigiani G et al. Rejoinder. J Am Stat Assoc. Dec; 104(488): 1318-1323, 2009.
27. Aven T, Eidesen K. A predictive Bayesian approach to risk analysis in health care. BMC Med Res Methodol. Aug 23; 7(38), 2007.
28. Signore A, Picarelli A, Annovazzi A. et al. 123I-Interleukin-2: biochemical characterization and in vivo use for imaging autoimmune diseases. Nucl Med Commun. Mar; 24(3): 305-316, 2003.
29. Eggleton P, Nissim A, Ryan BJ et al. Detection and isolation of human serum autoantibodies that recognize oxidatively modified autoantigens. Free radic Biol med 57: 79-91, 2003.
30. Nissim A, Winyard PG, Corrigall V et al. Generation of neoantigenic epitopes after posttranslational modification of type II collagen by factors present within the inflamed joint. Arthritis Rheum 52: 3829-3838, 2005.
31. Dunne JL, Overbergh L, Purcell AW et al. Posttranslational modifications of protein in type 1 diabetes: the next step in finding the cure? Diabetes 61: 1907-1914, 2012.
32. Piacentini M, Colizzi V. Tissue transglutaminase: apoptosis versus autoimmunity. Immunol Today 20(3): 130-134, 1999.
33. Schellekens GA, de Jong BA, van den Hoogen FH et al. Citrulline is an essential constituent of antigenic determinants recognized by rheumatoid arthritis-specific autoantibodies. J Clin Invest 101(1): 273-281, 1998.
34. Goldbach-Mansky R, Lee J, McCoy A. et al. Rheumatoid arthritis associated autoantibodies in patients with synovitis of recent onset. Arthritis Res 2(3): 236-243, 2000.
35. Bas S., Genevay S., Meyer O. et al. Anti-cyclic citrullinated peptide antibodies, IgM and IgA rheumatoid factors in the diagnosis and prognosis of rheumatoid arthritis. Rheumatology (Oxford) 42(5): 677-680, 2003.
36. Stetler DA, Jacob ST. Phosphorylation of RNA polymerase I augments its interaction with autoantibodies of systemic lupus erythematosus patients. J Biol Chem 259(22): 13629-13632, 1984.
37. Neugebauer KM, Merrill JT, Wener MH et al. SR proteins are autoantigens in patients with systemic lupus erythematosus. Importance of phosphoepitopes. Arthritis Rheum 43(8): 1768-1778, 2000.
38. Monneaux F, Lozano JM, Patarroyo ME et al. T cell recognition and therapeutic effect of a phosphorylated synthetic peptide of the 70K snRNP protein administered in MR/lpr mice. Eur J Immunol 33(2): 287-296, 2003.
39. Mohamed A, Shoker A, Bendjelloul F et al. Improvement of experimental allergic encephalomyelitis (EAE) by thymoquinone: an oxidative stress inhibitor. Biomed Sci Instrum 39: 440-445, 2003.
40. Strollo R, Rizzo P, Spoletini M et al. HLA-dependent autoantibodies against post-translationally modified collagen type II in type I diabetes mellitus. Diabetologia 56: 563-572, 2013.
41. Barker A, Lauria A, Schloot N et al. Age-dependent decline of β-cell function in type 1 diabetes after diagnosis: a multi-centre longitudinal study. Diabetes Obes Metab. Mar; 16(3): 262-267, 2014.
42. Pitocco D, Di Stasio E, Crinò A et al. Age at diagnosis of type 1 diabetes and the effect of immunomodulatory therapies on residual beta cell function. Horm Metab Res. Jan; 40(1): 66-68, 2008.
43. Raz I, Ziegler AG, Linn T et al. Treatment of recent-onset type 1 diabetic patients with DiaPep277: results of a double-blind, placebo-controlled, randomized phase 3 trial. Diabetes Care. May; 37(5): 1392-1400, 2014.
44. Raz I, Avron A, Tamir M et al. Treatment of new-onset type 1 diabetes with peptide DiaPep277 is safe and associated with preserved beta-cell function: extension of a randomized, double-blind, phase II trial. Diabetes Metab Res Rev. May; 23(4): 292-298, 2007.
45. Schloot NC, Meierhoff G, Lengyel C et al. Effect of heat shock protein peptide DiaPep277 on beta-cell function in paediatric and adult patients with recent-onset diabetes mellitus type 1: two prospective, randomized, double-blind phase II trials. Diabetes Metab Res Rev. May; 23(4): 276-285, 2007.
46. Kordonouri O, Hartmann R, Pankowska E et al. Sensor augmented pump therapy from onset of type 1 diabetes: late follow-up results of the Pediatric Onset Study. Pediatr Diabetes. Nov; 13(7): 515-518, 2012.
47. Kielgast U, Krarup T, Holst JJ et al. Four weeks of treatment with liraglutide reduces insulin dose without loss of glycemic control in type 1 diabetic patients with and without residual beta-cell function. Diabetes Care. Jul; 34(7): 1463-1468, 2011.
48. Sarkar G, Alattar M, Brown RJ et al. Exenatide treatment for 6 months improves insulin sensitivity in adults with type 1 diabetes. Diabetes Care. Mar; 37(3): 666-670, 2014.
49. Drucker DJ. The biology of incretin hormones. Cell Metab. Mar; 3(3): 153-165, 2006.
50. Sherry NA, Chen W, Kushner JA et al. Exendin-4 improves reversal of diabetes in NOD mice treated with anti-CD3 monoclonal antibody by enhancing recovery of beta-cells. Endocrinology. Nov; 148(11): 5136-5144, 2007.
51..Hadjiyanni I, Baggio LL, Poussier P et al. Exendin-4 modulates diabetes onset in nonobese diabetic mice. Endocrinology. Mar; 149(3): 1338-1349, 2008.
52. Gangemi A, Salehi P, Hatipoglu B et al. Islet transplantation for brittle type1 diabetes: the UIC protocol. Am J Transplant. Jun; 8(6): 1250-1261, 2008.
53. Bunck MC, Diamant M, Cornér A et al. One-year treatment with exenatide improves beta-cell function, compared with insulin glargine, in metformin-treated type 2 diabetic patients: a randomized, controlled trial. Diabetes Care. May; 32(5): 762-768, 2009.
54. Sarkar G, Alattar M, Brown RJ et al. Exenatide treatment for 6 months improves insulin sensitivity in adults with type 1 diabetes. Diabetes Care. Mar; 37(3): 666-670, 2014.
55. Kielgast U, Krarup T, Holst JJ et al. Four weeks of treatment with liraglutide reduces insulin dose without loss of glycemic control in type 1 diabetic patients with and without residual beta-cell function. Diabetes Care. Jul; 34(7): 1463-1468, 2011.